
【题目】元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。

(1)如图所示的模型表示的分子中,可由A、D形成的是____。


c与氯气反应生成的二元取代物有____种,d分子的结构简式____。
(2)Na在F单质中燃烧产物的电子式为____。该燃烧产物中化学键的类型为:____。上述元素的最高价氧化物的水化物中,碱性最强的是____(写化学式)。
(3)A与D组成的化合物中,质量相同,在氧气中完全燃烧消耗氧气最多的是:____
(4)关于(1)中d分子有下列问题:
①d分子中同一平面的原子最多有____个。
②若用-C4H9取代d上的一个H原子,得到的有机物的同分异构体共有____种。
【答案】acd 1 ![]()
![]() 离子键和非极性共价键 KOH CH4 13 16
离子键和非极性共价键 KOH CH4 13 16
【解析】
A为H、D为C、F为O、G为Mg、Q为Al、M为S、R为Cl、N为K;
(1)由A、D形成的是烃,据此选择;c 为甲烷,与氯气反应生成的二元取代物为二氯甲烷,按空间构型判断种类,d为甲苯,据此写分子的结构简式;
(2)Na在F单质中燃烧产物为过氧化钠,据此写电子式并判断化学键的类型;上述元素中金属性最强的元素其最高价氧化物的水化物碱性最强;
(3)A与D组成的化合物为烃,质量相同,在氧气中完全燃烧消耗氧气最多的是氢质量分数最大的那个;
(4) d分子为甲苯,-C4H9有4种,据此回答;
(1)由A、D形成的是烃,据此选择acd;
答案为:acd;
c 为甲烷,与氯气反应生成的二元取代物为二氯甲烷,甲烷是正四面体结构,故二氯甲烷只有一种;
答案为:1;
d为甲苯,其结构简式为![]() ;
;
(2)Na在F单质中燃烧产物为过氧化钠,其电子式为![]() ,所含化学键为离子键和非极性共价键;上述元素中金属性最强的元素为K,则最高价氧化物的水化物碱性最强的为KOH;
,所含化学键为离子键和非极性共价键;上述元素中金属性最强的元素为K,则最高价氧化物的水化物碱性最强的为KOH;
答案为:![]() ;离子键和非极性共价键;KOH;
;离子键和非极性共价键;KOH;
(3)A与D组成的化合物为烃,等质量的甲烷、乙烯和甲苯中,氢质量分数最大的是甲烷,在氧气中完全燃烧消耗氧气最多的是甲烷;
答案为:甲烷;
(4)①d分子为甲苯,甲苯分子中有一个甲基,甲基是四面体结构,最多13个原子共面;
答案为:13;
②甲苯苯环上一个H被-C4H9取代时,-C4H9和甲基可以处以邻位、间位和对位,-C4H9有4种,可得12种同分异构体,当甲苯的甲基上有一个H被-C4H9替代,又可得到可得4种同分异构体,故一共16种;
答案为:16。


科目:高中化学 来源: 题型:
【题目】某实验小组同学利用下图装置对电化学原理进行了一系列探究活动。

(1)甲池为装置_______(填“原电池”或“电解池”)。
(2)甲池反应前,两电极质量相等,一段时间后,两电极质量相差28g,导线中通过_________mol电子。
(3)实验过程中,甲池左侧烧杯中NO3-的浓度_______(填“变大”、“变小”或“不变”)。
(4)其他条件不变,若用U形铜棒代替“盐桥”,工作一段时间后取出铜棒称量,质量___________(填“变大”、“变小”或“不变”)。若乙池中的某盐溶液是足量AgNO3溶液,则乙池中左侧Pt电极反应式为___________________________________,工作一段时间后,若要使乙池溶液恢复原来浓度,可向溶液中加入_____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备Cl2和新制Cl2水,如图所示:

根据上述实验过程,回答下列问题:
(1)实验开始前,应先进行的操作是________________________。
(2)装置中盛装浓盐酸的仪器名称是_________________,装置中若无盛饱和食盐水的洗气瓶,将导致____________________。
(3)要证明Cl2与水反应是可逆反应,则证明氯水存在Cl2分子的现象是_____,证明同时存在HCl和HClO的实验操作及现象是________________________。
(4)吸收Cl2尾气的化学反应方程式为________________________。
(5)向装有新制氯水的试管中加入适量KBr溶液,反应的化学方程式为:________________________,待充分反应后,再加入四氯化碳并振荡,观察到的现象是__________________________________。
(6)有一种含氯氧化物,含氧量18.4%,与水反应,生成HClO,该氧化物的化学式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定试样xNa2CO3·yNaHCO3的组成,某同学将质量为a g的试样加水溶解后,所得试样溶液进行如下实验:
![]()
注:NaHCO3溶液pH约为8.3,饱和H2CO3溶液pH约为4.0。
下列说法正确的是
A. 当pH=8.3时,溶液中只存在Na+、H+、HCO3-、Cl-、OH-
B. 溶液pH由8.3变为4.0过程中,发生反应:CO32- +2H+ =CO2↑+H2O
C. 若V2=2V1,则x=y
D. 试样中,NaHCO3的质量分数=[(8.4×10-3V2)/a]×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列叙述正确的是

A.Mg(s)所具有的能量高于MgX2(s)所具有的能量
B.MgCl2电解制Mg(s)和Cl2(g)是吸热过程
C.热稳定性:MgI2>MgBr2>MgCl2>MgF2
D.常温下氧化性:F2<Cl2<Br2<I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的物质转化关系中,A、H为常见的金属单质,其中A为紫红色金属;D、F为气体,其中F为黄绿色气体;B、G为两种常见的酸;由J生成I的反应是电子工业常用的反应。(部分生成物和反应条件未列出)
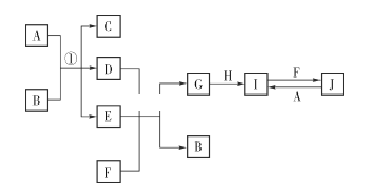
请回答下列问题:
(1)F的电子式为 ____________ 。
(2)G的化学式为 ____________。
(3)写出反应①的化学方程式:______________________________________________
(4)写出由J生成I的离子方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈CeO2是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末含(SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是____________________。滤渣1中加入稀酸A和H2O2发生反应的离子方程是为______________________。
(3)某同学设计实验证明滤液1中含有Fe2+,他所用的试剂的化学式为______________。
(4)己知溶液中的Fe2+可以和难溶于水的FeO(OH)反应生成Fe3O4,请书写该反应的离子方程式__________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式___________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,请用离子方程式解释其作用原理:___________________________ 。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________________(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
①________,②________,③________,④__________,⑤__________。
(2)图中现象c表明检验出的离子是________________。
(3)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(4)气体E通入试剂④发生反应的离子方程式是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com