
将1.12g铁粉加入25mL2mol•L﹣1的氯化铁溶液中,充分反应后,其结果是( )
A. 铁粉有剩余,溶液呈浅绿色,Cl﹣基本保持不变
B. 往溶液中滴入无色KSCN溶液,溶液变红色
C. Fe2+和Fe3+物质的量之比为5:1
D. 氧化产物和还原产物的物质的量之比为2:5
考点: 氧化还原反应的计算;铁的化学性质.
专题: 元素及其化合物.
分析: n(Fe)=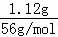 =0.02mol,n(FeCl3)=2mol/L×0.025L=0.05mol,二者反应方程式为2FeCl3+Fe=3FeCl2,根据方程式知,0.02molFe完全反应需要FeCl30.04mol<0.05mol,所以FeCl3有剩余,剩余n(FeCl3)=0.05mol﹣0.04mol=0.01mol,据此分析解答.
=0.02mol,n(FeCl3)=2mol/L×0.025L=0.05mol,二者反应方程式为2FeCl3+Fe=3FeCl2,根据方程式知,0.02molFe完全反应需要FeCl30.04mol<0.05mol,所以FeCl3有剩余,剩余n(FeCl3)=0.05mol﹣0.04mol=0.01mol,据此分析解答.
解答: 解:n(Fe)=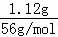 =0.02mol,n(FeCl3)=2mol/L×0.025L=0.05mol,二者反应方程式为2FeCl3+Fe=3FeCl2,根据方程式知,0.02molFe完全反应需要FeCl30.04mol<0.05mol,所以FeCl3有剩余,剩余n(FeCl3)=0.05mol﹣0.04mol=0.01mol,
=0.02mol,n(FeCl3)=2mol/L×0.025L=0.05mol,二者反应方程式为2FeCl3+Fe=3FeCl2,根据方程式知,0.02molFe完全反应需要FeCl30.04mol<0.05mol,所以FeCl3有剩余,剩余n(FeCl3)=0.05mol﹣0.04mol=0.01mol,
A.根据以上分析知,氯化铁有剩余,Fe完全反应,故A错误;
B.溶液中氯化铁有剩余,所以加入KSCN溶液时会生成硫氰化铁络合物而使溶液呈血红色,故B正确;
C.根据Fe和氯化亚铁的关系式知,生成n(FeCl2)=3n(Fe)=0.02mol×3=0.06mol,溶液中n(FeCl3)=0.01mol,所以Fe2+和Fe3+物质的量之比=0.06mol:0.01mol=6:1,故C错误;
D.该反应中氧化产物和还原产物都是氯化亚铁,氧化产物和还原产物的物质的量之比=1:2,故D错误;
故选B.
点评: 本题以铁、氯化铁为载体考查氧化还原反应有关计算,侧重考查分析计算能力,进行过量计算是解本题关键,利用方程式分析解答,易错选项是D.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
按如图所示的装置进行实验:
实验开始一段时间后,可观察到锥形瓶瓶口上方有白烟生成,请补充可能观察到的其他现象: .有关化学方程式为:① ;② ;③ ;④ .

查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验事实所作结论中,正确的是( )
| 实 验 事 实 | 结 论 | |
| A | A、B两种有机物具有相同的相对分子质量和不同的结构 | A、B互为同分异构体 |
| B | 质量相同的A、B两种有机物完全燃烧生成质量相同的水 | A、B两有机物最简式相同 |
| C | A、B两种有机物结构相似具有相同的通式 | A、B互为同系物 |
| D | 分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的结构简式可能是 CH2═CH≡C﹣CH═CH2 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
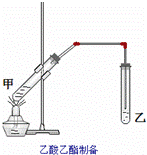
如图在试管甲中先加入2mL乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5mL饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
(1)该实验中长导管的作用是 ,其不宜伸入试管乙的溶液中,原因是 .
(2)试管乙中饱和Na2CO3的作用是①除去乙酸乙酯中的乙醇和乙酸,② .
(3)试管乙中观察到的现象是 .
(4)试管甲中加入浓硫酸的目的是①催化剂,吸水剂② 酸 .
(5)液体混合加热时液体体积不能超过试管容积的 ,本实验反应开始时用小火加热的原因是 ;(填字母)
a.加快反应速率
b.防止了反应物未来得及反应而挥发损失
(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,钠、镁、铝、铁分别跟足量的氯气反应时,消耗金属的质量与反应的氯气的质量之间的关系,其中表示铝与氯气反应的是( )
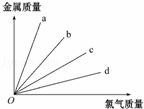
A. a B. b C. c D. d
查看答案和解析>>
科目:高中化学 来源: 题型:
磁流体是电子材料的新秀,它既有固体的磁性,又有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可产生黑色的、分散质粒子的直径为55nm~36nm的磁流体,下列说法中正确的是( )
A. 所得到的分散系为浊液
B. 该分散系的分散质为Fe(OH)3
C. 用一束光照射该分散系,可以看到一条光亮的“通路”
D. 该分散系极不稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C是三种元素的原子,质子数都小于18.A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3,C原子的质子数比A少4.回答下列问题:
(1)A、B、C的元素符号分别为 、 、 .
(2)A的离子结构示意图为 ;A与C组成的化合物电子式为 .
(3)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42﹣,1mol AB42﹣的质量为104g,则元素B的该核素中的中子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做完实验后,采用下列方法清洗所用仪器下列对以上操作的判断.正确的是( )
①用浓氨水清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗盛过苯酚的试管
⑥用热氢氧化钠的浓溶液清洗沾有硫磺的试管.
A. 除①外都对 B. 除⑥外都对 C. ④⑤不对 D. 全都正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com