
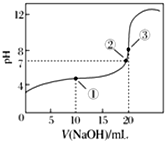
 常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )
常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
分析 A.根据点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,结合物料守恒分析;
B.点②pH=7,即c(H+)=c(OH-),NaOH与醋酸恰好反应生成醋酸钠显碱性;
C.点③体积相同,则恰好完全反应生成CH3COONa,溶液显碱性,醋酸根离子水解浓度减小;
D.刚开始滴定时,NaOH很少,溶液中主要是CH3COOH,CH3COOH发生部分电离,显酸性.
解答 解:A、根据点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,所以c(CH3COO-)+c(CH3COOH)=2c(Na+),故A错误;
B、点②pH=7,即c(H+)=c(OH-),NaOH与醋酸恰好反应生成醋酸钠显碱性,显中性,说明醋酸过量,所以c(Na+)<c(CH3COOH)+c(CH3COO-),故B错误;
C、点③说明两溶液恰好完全反应生成CH3COONa,溶液显碱性,醋酸根离子水解浓度减小,但是醋酸根离子的水解程度较小,则溶液中氢氧根离子浓度较小,故c(OH-)<<c(CH3COO-),正确的浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D、刚开始滴定时,NaOH很少,溶液中主要是CH3COOH,CH3COOH发生部分电离,显酸性,所以溶液中离子浓度为c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,明确混合后溶液中的溶质组成为解答关键,注意电荷守恒和物料守恒的应用,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和甲烷均是造成温室效应的气体 | |
| B. | 可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质 | |
| C. | 漂白液的有效成分是NaClO,制作计算机芯片的材料是SiO2晶体 | |
| D. | 食醋可去除水垢,NH4Cl溶液可去除铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
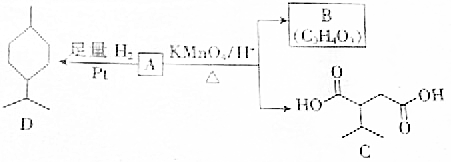
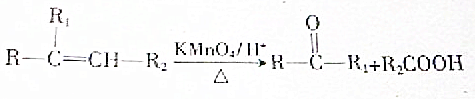
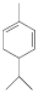 .A与等物质量的溴单质反应的产物有3种.
.A与等物质量的溴单质反应的产物有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 9:1 | C. | 10:1 | D. | 1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
| 进料液 | 0.30 | 310 |
| 电解后 | 0.32 | 210 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com