
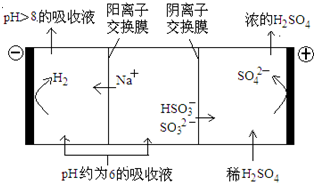
 (2012?北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(2012?北京)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
(2012?北京)下列用品的有效成分及用途对应错误的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
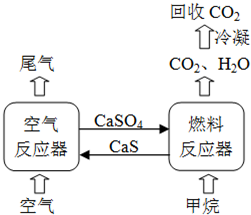 (2012?四川)直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙.硫酸钙可在有图所示的循环燃烧装置的燃料反应器重与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的.
(2012?四川)直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙.硫酸钙可在有图所示的循环燃烧装置的燃料反应器重与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的. .
.

查看答案和解析>>
科目:高中化学 来源: 题型:
| CuO/CuCl3 | 400℃ |



 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol 2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com