
按要求书写电极反应式和总方程式
(1)用惰性电极电解AgNO3溶液:
阳极反应式_______________________________________________________;
阴极反应式________________________________________________________;
总反应离子方程式__________________________________________________________。
(2)用惰性电极电解MgCl2溶液
阳极反应式________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应离子方程式___________________________________________________________。
(3)用铁作电极电解NaCl溶液
阳极反应式__________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应化学方程式______________________________________________________________。
(4)用铁作电极电解NaOH溶液
阳极反应式_________________________________________________________________;
阴极反应式________________________________________________________________;
总反应离子方程式______________________________________________________________。
(5)用铜作电极电解盐酸溶液
阳极反应式_________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应离子方程式______________________________________________________________。
(6)用Al作电极电解NaOH溶液
阳极反应式_________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应离子方程式______________________________________________________________。
(7)以铝材为阳极,电解H2SO4溶液,铝材表面形成氧化膜
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________;
总反应离子方程式______________________________________________________________。
(8)用Al单质作阳极,石墨作阴极,电解NaHCO3溶液
阳极反应式_______________________________________________________________;
阴极反应式_______________________________________________________________。
(9)用惰性电极电解熔融MgCl2
阳极反应式__________________________________________________________________;
阴极反应式_________________________________________________________________;
总反应离子方程式_______________________________________________________________。
答案 (1)4OH--4e-===O2↑+2H2O
4Ag++4e-===4Ag
4Ag++2H2O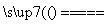 4Ag+O2↑+4H+
4Ag+O2↑+4H+
(2)2Cl--2e-===Cl2↑
2H++2e-===H2↑
Mg2++2Cl-+2H2O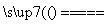 Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
(3)Fe-2e-===Fe2+
2H++2e-===H2↑
Fe+2H2O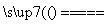 Fe(OH)2↓+H2↑
Fe(OH)2↓+H2↑
(4)Fe-2e-+2OH-===Fe(OH)2
2H++2e-===H2↑
Fe+2H2O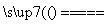 Fe(OH)2+H2↑
Fe(OH)2+H2↑
(5)Cu-2e-===Cu2+
2H++2e-===H2↑
Cu+2H+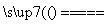 Cu2++H2↑
Cu2++H2↑
(6)2Al-6e-+8OH-===2AlO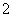 +4H2O 6H2O+6e-===3H2↑+6OH-或6H++6e-===3H2↑
+4H2O 6H2O+6e-===3H2↑+6OH-或6H++6e-===3H2↑
2Al+2H2O+2OH-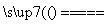 2AlO
2AlO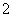 +3H2↑
+3H2↑
(7)2Al-6e-+3H2O===Al2O3+6H+
6H++6e-===3H2↑
2Al+3H2O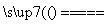 Al2O3+3H2↑
Al2O3+3H2↑
(8)2Al+6HCO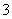 -6e-===2Al(OH)3↓+6CO2↑
-6e-===2Al(OH)3↓+6CO2↑
6H++6e-===3H2↑
(9)2Cl--2e-===Cl2↑
Mg2++2e-===Mg
Mg2++2Cl-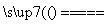 Mg+Cl2↑
Mg+Cl2↑


科目:高中化学 来源: 题型:
向等体积等物质的量浓度的H2S和SO2的水溶液中分别通入不同的气体,一段时间后,如图表示通入气体的量与溶液pH关系的曲线图,下列说法中正确的是( )
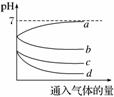
A.曲线a表示向H2S水溶液中通入O2
B.曲线b表示向SO2水溶液中通入O2
C.曲线c表示向H2S水溶液中通入Cl2
D.曲线d表示向SO2水溶液中通入H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.HF、HCl、HBr、HI的熔沸点依次升高
B.H2O的熔点、沸点大于H2S是由于H2O分子之间存在氢键
C.乙醇分子与水分子之间只存在范德华力
D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)B+C(g) ΔH=+Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是( )
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)反应∶n(C)生成=1∶1
C.若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q kJ
D.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡状态Ⅰ、Ⅱ、Ⅲ的相关数据如下表:
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979 K | 1 173 K | |||
| Ⅰ | Fe(s)+CO2(g)FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g)CO2(g)+H2(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g)FeO(s)+H2(g) | K3 | a | 1.68 |
根据以上信息判断,下列结论错误的是( )
A.a>b
B.增大压强,平衡状态Ⅱ不移动
C.升高温度,平衡状态Ⅲ向正反应方向移动
D.反应Ⅰ、Ⅲ均为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
两个惰性电极插入500 mL AgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解过程中阴极没有H2放出,且电解液在电解前后体积变化可以忽略不计),电极上析出银的质量最大为( )
A.27 mg B.54 mg C.106 mg D.216 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。
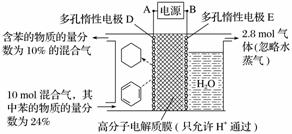
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________________________。
③该储氢装置的电流效率η=________。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
A.Fe(OH)3 Fe2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com