
下图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )

A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使反应向生成乙酸乙酯的方向移动
D.试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
下列物质的变化过程中,化学键没有被破坏的是( )
A.食盐溶解 B.干冰升华 C.氯化铵受热 D.氯化钠熔融
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:填空题
(8分)将稀硝酸逐滴加入盛有铝铁合金的容器中,当固体恰好完全溶解时,产生标准状况下NO 40.32L,将反应后的溶液平均分成三等份,分别进行如下实验:
(1)第一份溶液中逐滴加入2 mol·L-1NaOH溶液,至恰好达到最大沉淀,不考虑空气中O2的氧化,则需加入NaOH溶液的体积为________________。
(2)第二份溶液中边加入NaOH溶液,边在空气中充分搅拌,至恰好达到最大沉淀量,将产生的沉淀过滤、洗涤、干燥、称量比第一份重5.1g,则该过程中消耗O2的物质的量为_______________。
(3)第三份溶液中逐滴加入4 mol·L-1NaOH溶液,至Al(OH)3沉淀恰好溶解,消耗NaOH溶液500mL,计算原合金中铝的质量。(写出解题过程)(4分)
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.少量CO2通入Ba(OH)2溶液中:CO2+2OH—= CO32— +H2O
B.NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好沉淀完全
NH4++Al3++2SO42—+2Ba2++4OH—= NH3·H2O+Al(OH)3↓+2BaSO4↓
C.FeCl3溶液腐蚀铜线路板:Fe3++Cu = Fe2++Cu2+
D.向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3—+OH—= CO32—+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:实验题
(12分)某兴趣小组同学进行乙醛的银镜反应,实验操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。 B.在洗净的试管里配制银氨溶液。C.沿试管壁加入乙醛稀溶液。D.加热。请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是: 。
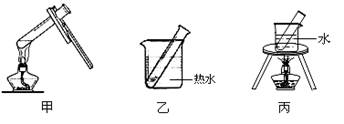
(2)步骤D应选择的加热方法是 (填下列装置编号)
(3)乙醛发生银镜反应的化学方程式为: 。
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
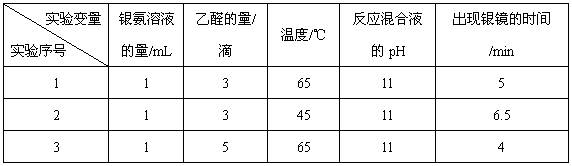
①实验1和实验2,探究的是 。
②当银氨溶液的量为1 mL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为 min。(填范围)
③你认为探究乙醛进行银镜反应的最佳条件,除了测定银镜出现的时间外,还需要比较不同条件下形成的银镜的 。
查看答案和解析>>
科目:高中化学 来源:2013-2014海口市第二学期高二化学期中考试(B卷)试卷(解析版) 题型:选择题
鉴别CH3OCH3和CH3CH2OH可采用化学方法和物理方法,下列方法不能对二者进行鉴别的是
A.利用金属钠或金属钾 B.利用质谱法
C.利用红外光谱 D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省绍兴市柯桥区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)太阳能电池是利用光电效应实现能量变化的一种新型装置,目前多采用单晶硅和多晶硅作为基础材料。高纯度的晶体硅可通过以下反应获得:
反应①(合成炉):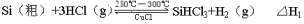
反应②(还原炉):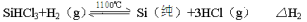
有关物质的沸点如下表所示:
物质 | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
沸点 | 12.1 | 73.5 | 57.0 | 129.4 | 180(升华) | 31.2 |
请回答以下问题:
(1)太阳能电池的能量转化方式为 ;由合成炉中得到的SiHCl3往往混有硼、磷、砷、铝等氯化物杂质,分离出SiHCl3的方法是 。
(2)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应①的KP= ;
(3)对于反应②,在0.1Mpa下,不同温度和氢气配比(H2/SiHCl3)对SiHCl3剩余量的影响如下表所示:
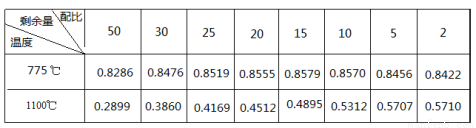
①该反应的△H2 0(填“>”、“<”、“=”)
②按氢气配比5:1投入还原炉中,反应至4min时测得HCl的浓度为0.12mol·L—1,则SiHCl3在这段时间内的反应速率为 。
③对上表的数据进行分析,在温度、配比对剩余量的影响中,还原炉中的反应温度选择在1100℃,而不选择775℃,其中的一个原因是在相同配比下,温度对SiHCl3 剩余量的影响,请分析另一原因是 。
(4)对于反应②,在1100℃下,不同压强和氢气配比(H2/SiHCl3)对SiHCl3剩余量的影响如图27—1所示:
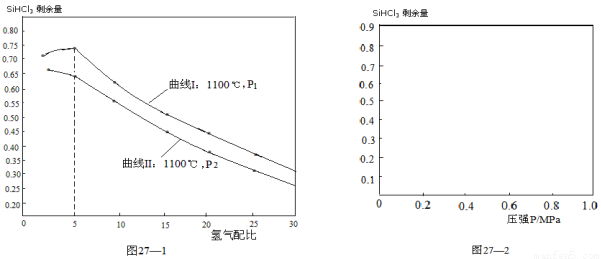
① 图中P1 P2(填“>”、“<”、“=”)
②在图27—2中画出氢气配比相同情况下,1200℃和1100℃的温度下,系统中SiHCl3剩余量随压强变化的两条变化趋势示意图。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:选择题
五种短周期元素的某些信息如表所示:
元素 | 有关信息 |
X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
Y | M层上有3个电子 |
Z | 短周期元素中原子半径最大的主族元素 |
W | 其单质是淡黄色固体 |
Q | 最高正价与最低负价代数和为6 |
下列说法正确的是
A.简单离子的半径大小顺序为:W>Q>Z>Y
B.Z单质在氧气中燃烧后的产物不能使品红溶液褪色
C.单质熔点高低的顺序为:Z>Y>X
D.Z与W元素只能形成原子个数比为2:1的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com