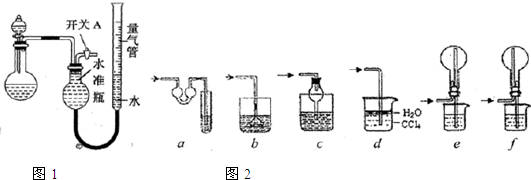
解答:解:(1)分液漏斗用于气体发生器中控制加液,也常用于互不相溶的几种液体的分离,加液时要注意内外空气相通,压强相等,液体才能顺利流下,具体操作为:打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加;
故答案为:打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加;
(2)一氧化氮与氧气反应生成二氧化氮,二氧化氮可与水反应生成一氧化氮和硝酸;装置Ⅰ中有空气,一氧化氮会与装置中的空气反应,生成的二氧化氮溶于水并与水反应,使测得的一氧化氮体积不准,所以不可以通过实验I收集并测量NO气体的体积来探究铜样品的纯度,
故答案为:NO会与装置中空气反应,生成NO
2溶于水,使测得的NO气体体积不准;
(3)实验室用电石和水来制取乙炔,反应原理为:CaC
2+2H
2O→Ca(OH)
2+C
2H
2↑,乙炔可以燃烧,乙炔燃烧时,火焰明亮并伴有浓烈的黑烟,这是因为乙炔中含碳的质量分数比乙烯高,碳没有完全燃烧的缘故,
故答案为:CaC
2+2H
2O→Ca(OH)
2+C
2H
2↑;火焰明亮并伴有浓烈的黑烟;
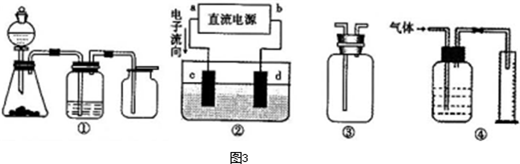
(4)氨气为碱性气体,极易溶于水,量气管中的液体应该不含水且不与氨气反应,浓NaOH溶液、氨水、氯化铵溶液中含有水,氨气被水吸收,而氨气不溶于煤油,所以量气管中液体最好是煤油;
a、对于极易溶于水的气体,吸收装置中的导管外联双球状导管内伸入到液体中,液体进入双球内,防止进入前端装置,能防止倒吸,故a正确;
b、吸收装置中的导管下联漏斗,漏斗口伸入液面以下,易吸收易溶性气体,不能防止倒吸,故b错误;
c、对于极易溶于水的气体,吸收装置中的导管与干燥管连接,当水进入干燥管内,烧杯内液面下降低于导管口,液体又流落到烧杯中,能防止倒吸,故c正确;
d、氨气极易溶于水,不溶于四氯化碳,所以导管通入四氯化碳中,气泡向上到水层溶解,能防止倒吸,故d正确;
e、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶口,液体经进气管倒流入前端装置,产生倒吸,故e错误;
f、氨气极易溶于水,导管插入溶液中形成喷泉,进气管在烧瓶底部,液体不能流入前端装置,能防止倒吸,故f正确;
所以能防倒吸的吸收装置有acdf,
故答案为:c; a、c、d、f;
(5)根据PV=nRT,为保证测出来的气体体积是当时大气压下的体积,在读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,因为相平说明两边液面上的压强是一样的,这样测出来的气体体积才是当时大气压下的体积,③视线与凹液面最低处相平,俯视或仰视会造成误差,
故答案为:使量气管和水准瓶两端液面相平;
(6)第2次测量数据误差较大,可不用,铝和氢氧化钠反应生成氢气的体积=
| (346.3-10.0)+(345.7-10.0) |
| 2 |
=336.0mL=0.336L
设生成0.336L氢气,需铝的质量为x
2Al+2NaOH+2H
2O═2NaAlO
2+3H
2↑
54g 3×22.4L
x 0.336L
=
,解之得:x=0.27g
铝的质量分数=
×100%=27.0%,
故答案为:27.0%.



 阅读快车系列答案
阅读快车系列答案