
| A�� | 1 g̼ȼ������һ����̼ʱ�ų�126.4 kJ������ | |
| B�� | 1 mol����̼��������ȼ������һ����̼����ʱ�ų�126.4 kJ������ | |
| C�� | 1 g̼ȼ������һ����̼ʱ����126.4 kJ������ | |
| D�� | 12 g̼��������Ӧ����һ����̼ʱ�ų�126.4 kJ������ |
���� ��Ӧ�������仯�����ʵ�״̬�����ʵ����йأ����Ȼ�ѧ����ʽ��ʾ������ȫת��ʱ�������仯����ѧ������ֻ��ʾ���ʵ������Դ������
��� �⣺��C��s��+$\frac{1}{2}$O2��g���TCO��g����H=-126.4kJ/mol��֪����ʾ1 mol����̼��������ȼ������һ����̼����ʱ�ų�126.4 kJ������������˵��CΪ���壬COΪ���壬
��ѡB��
���� ���⿼���Ȼ�ѧ����ʽ��Ϊ��Ƶ���㣬���շ�Ӧ�������仯�����ʵ�״̬���ʱ�Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע���Ȼ�ѧ����ʽ�����壬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CuCl2 | B�� | FeCl2 | C�� | FeCl3 | D�� | AlCl3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���¶Ȳ��䣬���������С��ԭ����һ�룬��ʱA��Ũ����ԭ����1.75������a+b��c+d | |
| B�� | ���¶Ȳ��䣬���������С��ԭ����һ�룬A��ת���ʿ��ܲ����� | |
| C�� | ��a+b=c+d��������������������������¶�ƽ�������ƶ��������������ѹǿ���� | |
| D�� | ��������ƽ����Է����������ٱ仯�Ǹ÷�Ӧ�ﵽƽ��ı�־֮һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϴ������ƿ������ƿ���ԷŽ������к�� | |
| B�� | �к��Ȳⶨʵ������ȼ���������ˮ��Ӱ��ⶨ��� | |
| C�� | �к͵ζ�ʵ���У��ô�װ��Һ��ϴ�ζ����Լ�Сʵ����� | |
| D�� | ����ͭ�ᾧˮ�����ⶨʵ����������������ƽ����3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
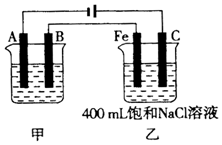 ��ͼΪ������ļס��������أ�
��ͼΪ������ļס��������أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ʳ�������������ĵ���� | |
| B�� | �ý��ݹ����������Һ�Ĺ���������ˮ���ͷŵ���ϩ���ɴﵽˮ�����ʵ�Ŀ�� | |
| C�� | һЩ��ҵ��ȼ�ϣ����յ���ȣ��������������ã�Ҳ������ʳ��ɫ�� | |
| D�� | �о���Ч�Ͷ���ũҩ�������߲˵�ũҩ������ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com