
| A. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 用湿润的pH试纸测溶液的pH,测定值一定有误差 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测中和热的值偏小 |
分析 A、滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积;
B、定容时俯视刻度线,导致所配溶液的体积偏小,结合c=$\frac{n}{V}$判断;
C、湿润的pH值试纸可以稀释溶液;
D、测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大.
解答 解:A、滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积,会导致所测溶液体积偏小,故A正确;
B、定容时俯视刻度线,导致所配溶液的体积偏小,结合c=$\frac{n}{V}$可知,所配溶液的浓度偏大,故B正确;
C、若溶液为中性,经蒸馏水润湿后,所测pH不变,故C错误;
D、测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大,所测温度偏小,中和热的值偏小,故D正确;
故选C.
点评 本题考查实验基本操作、误差分析等,难度中等,理解实验进行的原理是解题的关键,注实验基本操作的掌握.


科目:高中化学 来源: 题型:选择题
| A. | Cu(0H)2溶于氨水:Cu(0H)2+4NH3=[Cu(NH3)4]2++20H- | |
| B. | 足量的SO2通入Ca(C10)2溶液:Ca2++2C10-+S02═CaS04↓+2C1- | |
| C. | H2S04溶液与Ba(0H)2溶液反应:Ba2++0H-+H++S0${\;}_{4}^{2-}$═BaSO4↓+H20 | |
| D. | NaHC03溶液与过量澄清石灰水反应:2HC0${\;}_{3}^{-}$+Ca2++20H-═CaC03↓+CO${\;}_{3}^{2-}$+2H20 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
有一在空气中暴露过的NaOH固体,经分析知其含H2O7.65%,含Na2CO3 4.32%,其余是NaOH。若将ag样品放入bmL1mol/L的盐酸,使其充分作用后,残留酸用25.52mLcmol/L的NaOH溶液恰好中和完全。则蒸发所得溶液,得到固体质量的表达式中(单位为克)
A.应含有a B.只含有b C.比含有c D.一定有a、b、c
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2是…. b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4探究催化剂对该反应速率的影响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验温度 /℃ | Na2S2O3 | H2SO4 | 蒸馏水体积 /mL | ||
| 体积/mL | 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | |||
| ① | 25 | 10 | 0.1 | 10 | 0.1 | 0 |
| ② | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| ③ | 25 | 5 | 0.2 | 10 | 0.2 | 5 |
| ④ | 50 | 5 | 0.1 | 10 | 0.1 | 5 |
| ⑤ | 50 | 10 | 0.2 | 5 | 0.2 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
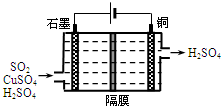 一种以铜作催化剂脱硫有如下两个过程:
一种以铜作催化剂脱硫有如下两个过程:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数多 | |
| C. | 5.2g 26Al3+中所含的电子数约为6.02×1024 | |
| D. | 26Al和26Mg的质子数和核外电子数均不相同,中子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com