
(13分)SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下:

已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
②BaCO3的相对分子质量是197; BaCl2.2H2O的相对分子质量是244。
(1)SiCl4发生水解反应的化学方程式 。
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式 。
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2;② ;
(4)生成滤渣A的离子方程式: ;
(5)BaCl2滤液经 、 、过滤、洗涤,再经真空干燥后得到BaCl2.2H2O。
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_ 吨。
(1)SiCl4+4H2O=H4SiO4↓+4HCl (2)3SiCl4+4NH3 Si3N4+12HCl
Si3N4+12HCl
(3)使Fe3+完全沉淀 (4)Mg2++2OH-=Mg(OH)2↓ (5)蒸发浓缩,降温结晶 (6)9.76
【解析】
试题分析:(1)根据原子守恒可知SiCl4发生水解生成硅酸和盐酸,反应的化学方程式为SiCl4+4H2O=H4SiO4↓+4HCl。
(2)粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,则根据原子守恒可知反应中还有氯化氢生成,因此该反应的化学方程式为3SiCl4+4NH3 Si3N4+12HCl。
Si3N4+12HCl。
(3)由于溶液中含有铁离子,而铁离子完全沉淀时的pH值是3.2,所以加钡矿粉调节pH=7的作用之二是使Fe3+完全沉淀。
(4)由于在加入氢氧化钠溶液之前滤液中还含有镁离子,所以加入氢氧化钠溶液后镁离子转化为氢氧化镁沉淀,则生成滤渣A的离子方程式为Mg2++2OH-=Mg(OH)2↓。
(5)从滤液中得到氯化钡晶体的操作是将滤液经蒸发浓缩,降温结晶、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O。
(6)根据原子守恒可知10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O的质量是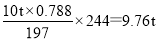 。
。
考点:考查物质制备工艺流程图的分析与判断


科目:高中化学 来源:2014-2015学年云南省弥勒市高三市统测一模理综化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列叙述正确的是
A.在有机化工中,氯气是合成塑料、橡胶、农药和人造纤维的重要原料
B.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.油脂是产生能量很高的营养物质,在饮食中不必控制油脂的摄入量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1mol甲醇中含有C—H键的数目为4NA
B.常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1 NA
C.7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为 0.1NA
D.80℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下图为“长式元素周期表”的一部分,其中短周期元素W、X、Y、Z的位置关系如图。下列说法一定正确的是

A.元素Z位于元素周期表的第3周期ⅦA族
B.原子半径的大小顺序为:rY>rW>rX
C.元素W的最高价氧化物对应水化物的酸性比Y的强
D.元素X的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.CO2的电子式: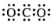
B.Cl-的结构示意图:
C.乙醇的结构式:C2H6O
D.中子数为53、质子数为78的碘原子:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:选择题
下列各组离子能在指定环境中大量共存的是:
A.在c(HCO3-)=0.1 mol.L-1的溶液中:NH4+、AlO2—、Cl-、NO3—
B.在由水电离出的c(H+)=l×l0-12 ·mol.L-1的溶液中:Fe2+、ClO-、Na+、SO42-
C.在加入铝粉产生H2的溶液中:SO42-、NO3一、Na+、NH4+
D.在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、F—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:填空题
(14分)铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶 液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是 (用电极反应式解释)溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:

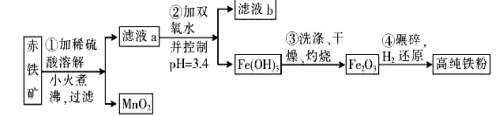
已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(3)步骤②中加双氧水的目的是 ,pH控制在3. 4的作用是 。已知25°C时,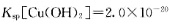 ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净?
(5)制备氮化铁磁粉的反应: (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市高三上学期期末理综化学试卷(解析版) 题型:选择题
分子式为C10H12O2的有机物,满足以下两个条件:①苯环上有两个取代基,②能与NaHCO3反应生成气体。则满足条件的该有机物的同分异构体有
A.9 B.10 C.12 D.15
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:实验题
(16分)某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,草酸在常温下呈无色晶体状,其晶体的熔化温度低于草酸的分解温度,且易升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为____________________________________。
(2)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
①该实验说明草酸具有________(填“氧化”或“还原”)性,该反应的反应速率先慢后快的主要原因可能是_______ _ ______。
②请配平该反应的离子方程式:______MnO4-+____H2C2O4+____ ===____Mn2++____CO2↑+____。
(3)为了探究草酸的不稳定性,某同学设计了如下实验装置:

①C、H装置均变浑浊,E处无现象,G玻璃管里黑色变红色,写出A中反应的化学方程式: 。
②上述装置中,B装置的作用是 。 D的作用是 。从环境保护角度来看,该方案的不足之处是 。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为_______________(用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com