
�¶�ΪT�棬ѹǿΪ1.01��106 Pa�����£�ij�ܱ������з�����Ӧ��A(g)��aB(��)  4C(g)���ﵽ��ѧƽ��ʱ���c(A)��0.2 mol��L��1��ѹ������ʹѹǿ����2.02��106 Pa���ڶ��δﵽƽ��ʱ�����c(A)��0.36 mol��L��1��������ѹ��������ʹѹǿ����5.05��106 Pa�������δﵽƽ��ʱ�����c(A)��1.1 mol��L��1���������й�˵������ȷ���� (����)
4C(g)���ﵽ��ѧƽ��ʱ���c(A)��0.2 mol��L��1��ѹ������ʹѹǿ����2.02��106 Pa���ڶ��δﵽƽ��ʱ�����c(A)��0.36 mol��L��1��������ѹ��������ʹѹǿ����5.05��106 Pa�������δﵽƽ��ʱ�����c(A)��1.1 mol��L��1���������й�˵������ȷ���� (����)
A���ڶ���ƽ��ʱBΪ��̬
B. a>3
C����һ��ƽ�������ѹǿƽ�������ƶ�
D�������δﵽƽ��ʱBΪ����̬
 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ�������£������ΪVL���ܱ������У�һ����̼��������Ӧ���ɼ״���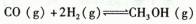
��ͼ��ʾ�÷�Ӧ�ڲ�ͬ�¶��µķ�Ӧ���̣�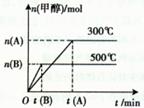
���ڸ÷�Ӧ������˵����ȷ���ǣ��� ��
| A����Ӧ��ƽ��������¶ȣ�ƽ�ⳣ��K���� |
| B����Ӧ������ʹ��Cu2O/ZnO�����������߾����μӷ�Ӧ�� |
C��500�淴Ӧ�ﵽƽ��ʱ�����������ʵ���Ũ�ȼ��ٱ�ʾ�÷�Ӧ�ķ�Ӧ�����ǣ�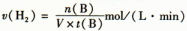 |
| D��300�淴Ӧ�ﵽƽ����������������䣬�������С��ԭ����1/2��ƽ�����ƣ��������ʵ���Ũ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪N2(g)��3H2(g) 2NH3(g) ��H=?92.4 kJ��mol��1�����¶���ͬ���ݻ���Ϊ2 L��3�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��£���÷�Ӧ�ﵽƽ��ʱ���й��������£�����˵����ȷ����
2NH3(g) ��H=?92.4 kJ��mol��1�����¶���ͬ���ݻ���Ϊ2 L��3�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��£���÷�Ӧ�ﵽƽ��ʱ���й��������£�����˵����ȷ����
| ���� | �� | �� | �� |
| ��Ӧ��Ͷ���� | 1 mol N2��3 mol H2 | 2 mol N2��6 mol H2 | 2 mol NH3 |
| NH3��Ũ�ȣ�mol��L��1�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | �ų�Q1 kJ | �ų�Q2 kJ | ����Q3 kJ |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�ܱ������������·�Ӧ��aX��g����bY��s��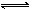 nW��g������H��Q��ij��ѧ��ȤС���ͬѧ���ݴ˷�Ӧ�ڲ�ͬ�����µ�ʵ�����ݣ���������������ͼ���� ��
nW��g������H��Q��ij��ѧ��ȤС���ͬѧ���ݴ˷�Ӧ�ڲ�ͬ�����µ�ʵ�����ݣ���������������ͼ���� ��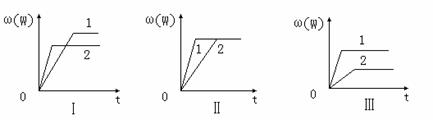
���У��أ�W����ʾW�ڷ�Ӧ������еİٷֺ�����t��ʾ��Ӧʱ�䡣������������ʱ�����з�����ȷ���ǣ� ��
| A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2��P1��a��n |
| B��ͼ���������ͬ��ͬѹ�´����Է�Ӧ��Ӱ�죬��2ʹ�õĴ���Ч���� |
| C��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P1��P2��n=a��b |
| D��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2��Q��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
Ϊ�˽�һ���о�����ͭ�����������������ʵ�Ӱ�죬ijͬѧ��������һϵ��ʵ�顣�������������Լ���һ�������Ϻֱ�����ĸ�ʢ�й���Zn���ķ�Ӧƿ(�ס��ҡ�������)�У��ռ����������壬��¼�ռ���ͬ�������������ʱ�䡣
| ʵ�� �Լ�/mL | �� | �� | �� | �� |
| 4 mol/L H2SO4 | 20 | V1 | V2 | V3 |
| ����CuSO4��Һ | 0 | 2.5 | V4 | 10 |
| H2O | V5 | V6 | 8 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij��ȤС��Ϊ̽����������Կ��淴ӦA(g)��B(g)  C(g)��D(s)��Ӱ�죬����������ʵ�飺���������£���һ���ݻ�Ϊ10 L���ܱ������г���1 mol A��1 mol B����Ӧ��ƽ��ʱ��������и����ʵ�Ũ��ΪI��Ȼ��ı䲻ͬ��������������ʵ�飬���´ﵽƽ��ʱ�����и��ɷֵ�Ũ�ȷֱ�Ϊ����
C(g)��D(s)��Ӱ�죬����������ʵ�飺���������£���һ���ݻ�Ϊ10 L���ܱ������г���1 mol A��1 mol B����Ӧ��ƽ��ʱ��������и����ʵ�Ũ��ΪI��Ȼ��ı䲻ͬ��������������ʵ�飬���´ﵽƽ��ʱ�����и��ɷֵ�Ũ�ȷֱ�Ϊ����
| | A | B | C |
| �� | 0.050 mol��L��1 | 0.050 mol��L��1 | 0.050 mol��L��1 |
| �� | 0.070 mol��L��1 | 0.070 mol��L��1 | 0.098 mol��L��1 |
| �� | 0.060 mol��L��1 | 0.060 mol��L��1 | 0.040 mol��L��1 |
| �� | 0.080 mol��L��1 | 0.080 mol��L��1 | 0.12 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���¶��£���ӦC(s)��H2O(g)  CO(g)��H2(g)�ﵽƽ��ı�־��(����)
CO(g)��H2(g)�ﵽƽ��ı�־��(����)
| A������Ӧ���淴Ӧ���ʾ�Ϊ�� |
| B��v(H2O����)��v(CO����) |
| C����λʱ���ڷ�Ӧ����ٵķ������������������ӵķ����� |
| D��ѹǿ����ʱ��ı仯���仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�ں��¡����ݵ��ܱ������з�����ӦA��g�� B��g����C��g��������Ӧ���Ũ����2 mol/L����0.8 mol/L��20 s����ô��Ӧ��Ũ����0.8 mol/L����0.2 mol/L�����ʱ��Ϊ
B��g����C��g��������Ӧ���Ũ����2 mol/L����0.8 mol/L��20 s����ô��Ӧ��Ũ����0.8 mol/L����0.2 mol/L�����ʱ��Ϊ
| A��10 s | B������10 s | C��С��10 s | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ڿ��淴ӦH2��g����I2��g�� 2HI��g�������¶�һ������H2��g����I2��g����ʼ��Ӧ������˵����ȷ���ǣ� ��
2HI��g�������¶�һ������H2��g����I2��g����ʼ��Ӧ������˵����ȷ���ǣ� ��
| A��H2��g��������������HI��g������������֮��Ϊ2��1 |
| B����Ӧ���еľ������������淴Ӧ����֮�� |
| C�������淴Ӧ���ʵı�ֵ�Ǻ㶨�� |
| D���ﵽƽ��ʱ�������淴Ӧ������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com