
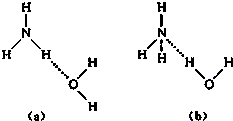
 完成下列各题
完成下列各题 NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是 NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b);
NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b);

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有________种。
(2)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为______________。在GaN晶体中,每个Ga原子与__________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于_______晶体。
(3)在极性分子NCl3中,N原子的化合价为-3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是_________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
请完成下列各题:
(1)前4周期中,基态原子中未成对电子数为4的元素原子的电子排布式为________________。
(2)NaCl晶体中,与Na+等距离且最近的Na+有________________个。
(3)N 原子的第一电离能___________(填 “>”“<” 或“=”)O原子的第一电离能,N2分子中存在_______个σ键和_______个π键,NH3的沸点比PH3_________(填“高”或“低”),![]() 中N原子的杂化方式为________________,
中N原子的杂化方式为________________,![]() 的空间构型为________________。
的空间构型为________________。
查看答案和解析>>
科目:高中化学 来源:2010年福建省、惠安一中、安溪一中高二上学期期中联考化学试卷 题型:填空题
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) 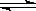 CH3OH(g)。根据题意完成下列各题:
CH3OH(g)。根据题意完成下列各题:

(1) 判断该反应达到平衡状态的标志是 。(填字母)
a.CO和CH3OH浓度相等
b.CO百分含量保持不变
c.容器中气体的压强不变
d.CH3OH的生成速率与CO的消耗速率相等
e.容器中混合气体的密度保持不变
(2) 欲提高CO的转化率,下列措施可行的是
。(填字母)
a.向装置中再充入N2 b.向装置中再充入H2
c.改变反应的催化剂 d.升高温度
(3) 反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4) 在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(5) 在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源:2012届浙江省高二下学期期中考试化学试卷 题型:填空题
(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:______________________________ (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2012届云南省高二下学期期中考试化学试卷 题型:填空题
(15分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)

根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_____________________________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com