
| A. | 溴化碘能与金属和非金属反应 | B. | 它可与水反应:IBr+H2O→HBrO+HI | ||
| C. | 它可KI溶液反应 KI+IBr→KBr+I2 | D. | 固体溴化碘是一种分子晶体 |
分析 溴化碘(IBr)是卤素互化物的一种,这种化合物在常温常压下是深红色的固体,卤素互化物的化学性质跟卤素单质相似,其氧化性介于形成该互化物两卤素单质之间,IBr+H2O=HBr+HIO中,各元素的化合价不发生变化,IBr中I为+1价,Br为-1价,为双原子分子,
A.其氧化性介于形成该互化物两卤素单质之间,由氯气性质推断;
B.与水反应IBr+H2O=HBr+HIO中,各元素的化合价不发生变化;
C.IBr其氧化性介于形成该互化物两卤素单质之间能氧化碘离子;
D.熔点为41℃,沸点为116℃.分析可知IBr为分子晶体.
解答 解:A.其氧化性介于形成该互化物两卤素单质之间,由氯气性质推断溴化碘能与金属和非金属反应,故A正确;
B.与水反应发生的是复分解反应,各元素的化合价不发生变化,反应的化学方程式为:IBr+H2O=HBr+HIO中,故B错误;
C.IBr其氧化性介于形成该互化物两卤素单质之间能氧化碘离子,它可KI溶液反应 KI+IBr→KBr+I2,故C正确;
D.熔点为41℃,沸点为116℃.分析可知固体IBr为分子晶体,故D正确;
故选B.
点评 本题考查了卤素互化物性质的分析判断,注意类比分析方法的应用,注意反应过程中元素化合价的变化,掌握基础是解题关键,题目难度不大.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 无论在纯水中,还是在稀溶液中,由水电离出的c(H+)与c(OH-)相等 | |
| B. | pH=7的溶液不一定呈中性,c(H+)=c(OH-) 的溶液才是中性溶液 | |
| C. | 无论是酸溶液还是碱溶液中,由水电离出的c(H+)小于纯水电离出的c(H+) | |
| D. | 常温下,在1 mol/L 盐酸中,水的离子积Kw>1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol钠与过量盐酸反应生成NA个H2分子 | |
| B. | 少量金属钠加到冷水中,反应的离子方程式是:Na+2H2O═Na++OH-+H2↑ | |
| C. | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 | |
| D. | 为测定熔融NaOH的导电性,可在瓷坩埚中熔化NaOH固体后进行测量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5d | B. | 6d | C. | 7d | D. | 8d |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
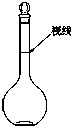 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
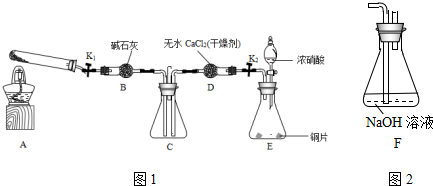
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入氯水,然后加入KSCN溶液,检验该溶液中是否含有Fe2+ | |
| B. | 向偏铝酸钠溶液中通入过量CO2,制备氢氧化铝 | |
| C. | 用金属钠分别与水和乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性 | |
| D. | 用检验Na2CO3和Na2SO4水溶液酸碱性实验,证明碳和硫两元素非金属性的强弱. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com