
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。

请回答下列问题:
(1)实验室制取氨气的化学方程式为_________;
(2)装置A中的烧瓶内固体不可以选用________(选填序)
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(3)装置F中发生反应的离子方程式是_________;
(4)B装置的作用_________;E装置的作用_________;
(5)若装置C内出现浓厚的白烟并在容器内壁凝结,且另一生成物是空气的主要成分之一。请写出反应的化学方程式:_________;
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,可以将尾气通入盛有_________溶液的烧杯来处理。
【答案】2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O C MnO2+4H++2Cl-
2NH3↑+CaCl2+2H2O C MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 干燥氨气 除去氯气中的氯化氢 3Cl2+8NH3=N2+6NH4Cl NaOH
Mn2++Cl2↑+2H2O 干燥氨气 除去氯气中的氯化氢 3Cl2+8NH3=N2+6NH4Cl NaOH
【解析】
在装置A中用用浓氨水与CaO等碱性物质反应制取NH3,经装置B干燥后通入装置C中;在装置F中用MnO2与浓盐酸混合加热发生反应制取Cl2,浓盐酸具有挥发性,经装置E中饱和食盐水除去Cl2中的杂质HCl,然后经过装置D浓硫酸干燥后,在C装置中HCl与NH3发生反应,产生白色固体NH4Cl,同时产生的另一生成物是空气的主要成分之一,则该气体为N2。HCl、NH3都是有害气体,多余的气体要经尾气处理后才能排放。
(1)在实验室中一般是用NH4Cl和Ca(OH)2混合加热制取氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+ 2H2O;
CaCl2+2NH3↑+ 2H2O;
(2)装置A中的烧瓶内氨水与碱性物质混合会产生氨气,烧瓶内的固体不可以选用酸性物质,在题目给出的物质中,只有五氧化二磷与水反应产生磷酸,磷酸属于酸,磷酸与氨水反应产生磷酸铵,不能产生氨气,故合理选项是C;
(3)装置F中浓盐酸与MnO2混合加热反应产生MnCl2、Cl2、H2O,反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(4)B装置的作用是干燥氨气;E装置的作用除去Cl2中的杂质HCl;
(5)若装置C内出现浓厚的白烟并在容器内壁凝结,该白色固体是NH4Cl,另一生成物是空气的主要成分之一,根据物质的元素组成可知该气体为N2。结合氧化还原反应规律,可得该反应的化学方程式:3Cl2+8NH3=N2+6NH4Cl;
(6)从装置C的G处逸出的尾气中含有黄绿色的有毒气体是Cl2,由于Cl2能够与碱反应产生可溶性的物质,可通过将尾气通入盛有NaOH溶液的烧杯进行尾气处理。


科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过。电池充、放电的化学方程式为2Na2S2+NaBr3![]() Na2S4+3NaBr。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
Na2S4+3NaBr。当闭合K时,X极附近溶液先变红色。下列说法正确的是( )
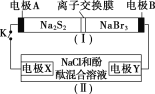
A.装置(Ⅰ)中Na+从右到左通过离子交换膜
B.电极A的电极反应式为NaBr3+2Na++2e-=3NaBr
C.电极X的电极反应式为2Cl--2e-=Cl2↑
D.每有0.1molNa+通过离子交换膜,电极X上就析出标准状况下的气体1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL混合液中,HNO3和H2SO4物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1.92gCu粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是( )
A.0.15 mol/LB.0.3 mol/LC.0.1 mol/LD.0.225 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A.甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种
B.等物质的量CH4和乙酸分别在氧气中完全燃烧,耗氧量相同
C.某有机物燃烧只生成物质的量之比为1:2的CO2和H2O,说明其分子式为CH4
D.![]() 的名称为:3甲基庚烷
的名称为:3甲基庚烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均釆用虚线表示。
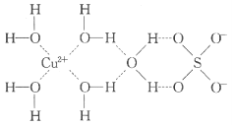
(1)写出基态Cu原子的核外电子排布式____,S原子的价层电子排布图______
(2)写出胆矾晶体中水合铜离子的结构简式_____(必须将配位键表示出来)。
(3)向CuSO4溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式_____。比较NH3和[Cu(NH3)4]2+中H-N-H 中键角的大小:NH3_____[Cu(NH3)4]2+(填“![]() ” “
” “![]() ” 或“=”)。
” 或“=”)。
(4)已知H2O2的结构如图:
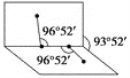
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因______。
(5)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B |
| |
CO | 357.7 | 798.9 | 1 071.9 |
N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中两种物质作用时,反应条件或反应物用量改变,对生成物没有影响的是( )
A.Na与O2B.Na2O2与CO2C.NaOH与CO2D.Cu与HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计城市机动车辆每年以15%至20%的速度增长,交通事故也频发,汽车在剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。则下列判断正确的是
A. 还原剂与氧化产物的物质的量之比为5:8
B. 若氧化产物比还原产物多1.4mol则转移电子为1mol
C. 每生成1.6mol氮气,则有0.2molKNO3被氧化
D. NaN3是只含有离子键的离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com