
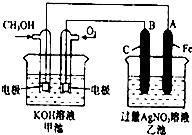
 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O 填写下列空白:分析 (1)根据方程式及燃料电池的特点判断甲装置;
(2)根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极,O2 发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以石墨电极B是阳极;
(3)根据乙池的总反应判断pH变化;
(4)先根据得失电子数相等找出银与氧气的关系式,然后计算.
解答 解:(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池,故答案为:原电池;电解池;
(2)根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极,反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;O2 发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以石墨电极B是阳极;故答案为:负极;CH3OH-6e-+8OH-=CO32-+6H2O;阳极;
(3)乙池中离子放电顺序为:阳离子 Ag+>H+,阴离子OH->NO3-,依据氧化还原反应的电子守恒,结合反应的物质书写化学方程式:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag↓+O2↑+4HNO3,生成酸,所以pH变化为降低,故答案为:降低;
(4)根据得失电子数相等,氧气与银的关系式为:
O2--------4Ag
22.4L ( 4×108 )g
0.28L 5.4g
故答案为:280.
点评 原电池、电解池的判断方法:
1、若无外加电源,可能是原电池,然后再根据原电池的形成条件判定.
2、若有外接电源,两电极插入电解质溶液中,可能是电解池或电镀池,当阳极金属与电解质溶液中的金属阳离子相同时,则为电镀池.
3、若无明显外接电源的串联电路,则利用题中信息找出能自发进行氧化还原反应的装置为原电池.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .写出C与NaOH水溶液共热反应的化学方程式
.写出C与NaOH水溶液共热反应的化学方程式 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$ +2NaBr+H2O.
+2NaBr+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实 验 操 作 | 答案 | 实验现象 |
| (1)向鸡蛋清中滴加少许浓硝酸,微热 | B | A.紫色褪去 B.变黄色 C.出现蓝色 D.溶液分层,下层呈紫红色 |
| (2)将乙烯通入少量酸性KMnO4溶液中 | A | |
| (3)将CCl4滴入盛有碘水的试管中,充分振荡,静止 | D | |
| (4)向土豆片上滴加碘水 | C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4 OH-═2 Ba SO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,反应类型加聚反应;
,反应类型加聚反应;
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,100 mL 0.35 mol•L-1的KCl饱和溶液蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
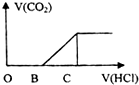 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )
向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示.则下列分析与判断正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2═HCO3- | |
| C. | 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) | |
| D. | 若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com