
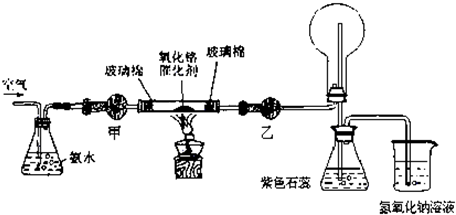
ijʵ��С�����������װ�ý��а��Ĵ�����ʵ�顣

��1�������£���5��8 mol/L����ˮʱʵ���������ԣ�����Ũ��ˮ���Ƹ�Ũ�ȵ���ˮ480mL����Ҫ�ձ���������������Ҫ������������????? ??????????????????? ????? ��
��2���״�ҩƷ������Ϊ_____________��
��3��ʵ��ʱ���Ƚ��������������ȣ��ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵����Ӧ��_____���������������������ȷ�Ӧ����ѧ����ʽΪ??? ?????????? ���Ҵ�������ˮ�Ȼ��ƣ���ƿ��������Ӧ�Ļ�ѧ����ʽΪ___?????????????????????? ����ƿ������������Ϊ? ??????????????? _��
��4�����ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в���������Ϊ? ?????????? ��
��5������þ��ʯī���缫��Ũ�Ȼ����Һ�����Һ����ԭ��أ������ĵ缫��ӦʽΪ? ??????????? ��
��1����Ͳ����ͷ�ι���500mL����ƿ ��2�֣�ȱһ���1�֣�
��2����ʯ�ң�2�֣���?
��3�����ȷ�Ӧ��1�֣���? 4NH3��5O2 4NO��6H2O��2�֣���2 NO��O2��2NO2��2�֣���
4NO��6H2O��2�֣���2 NO��O2��2NO2��2�֣���
��4���к���ɫ�������ɣ��������̣�2������1����?
��5��2 NH4++ 2e����2NH3��+H2����2�֣���
��������
�����������1������һ�����ʵ���Ũ�ȵİ�ˮ����Ҫ������Ͳ��ȡŨ��ˮ����Һ���480 mL����Ҫ500 mL����ƿ������õ���ͷ�ιܶ��ݣ���2�����ﰱ���ü�ʯ�ң���3����Ԥ�ȣ�������Ӧ��Ȼ��ֹͣ���ȣ���Ӧ��Ȼ���Խ��У�˵���÷�Ӧ�Ƿ��ȷ�Ӧ�����Ĵ���������NO��ˮ��NO������ƿ��������Ӧ����NO2����ɫ���壬��ƿ�е��ܿ������ݲ�����ͬʱ��Һ��Ϊ��ɫ��Һ���Ϸ����ֺ���ɫ���壻��4�����ȱ���Ҵ�����ˮ�Ȼ��Ƶ�������NO��ˮ�Ͱ����ͻ������ƿ�У�NO���������ɺ���ɫ����NO2 ��NO2��ˮ��Ӧ�������ᣬ�����백����Ӧ��������粒��壬�ῴ�����̣���5���������¹���ԭ��أ������Ϊˮ�������Ե��Ȼ����Һ������Ϊþʧ���ӣ�������H+ �õ��ӣ�OH- ���࣬���������Լ��ԣ�������εļ�⣬�а����ų�����������ӦΪ��2 NH4++ 2e����2NH3��+H2����
���㣺�����Ĵ�������������������ʣ����缫��Ӧʽ��д��


 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д� ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ���� |
| ||
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �����Լ�X |
| ����O2������� |
| �ܷ�(�����������ƶ��Ļ���) |
| ||
| �����Լ�Y |
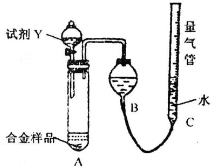
| 1-V3 |
| 6.72 |
| 1-V3 |
| 6.72 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ������������֡����֡���ɽ��������������ѧ�ڶ�ģ��ѧ�Ծ��������棩 ���ͣ�ʵ����
ijʵ��С�����������װ�ý��а��Ĵ�����ʵ�顣
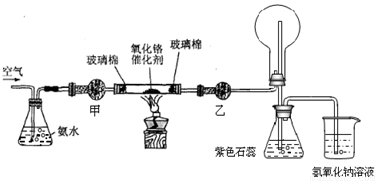
���������գ�
��1�������£���ˮ��Ũ��Ϊ1:1.5��28%��Ũ��ˮ��ˮ������ȣ�ʱʵ���������ԣ����Ƹ�Ũ�Ȱ�ˮ�IJ��������� ��
��2����ʵ���õĸ�����Ǽ�ʯ�Һ���ˮ�Ȼ��ơ���״���____________���Ҵ���___________��
��3��ʵ��ʱ���Ƚ��������������ȣ��ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵����Ӧ��_____��������š����ȷ�Ӧ����ѧ����ʽΪ ��
��4��ʵ��ǰ���ձ���ʢ��200mL 1.000 mol/L�� NaOH��Һ��ʵ������ձ�����Һ��pH=13������Һ�����ȷ�Ӧǰ������7.48g����NaOH��Һ���յ�NO��NO2�����ʵ���֮��
�� ������Һ����������Һ��������ˮ�⣩��
��5��ʵ��ʱ���֣����ȱ���Ҵ��ĸ���ܣ�����Ӧ�������ֱ��ͨ����ƿ������ƿ�в������̡���ԭ����û�ѧ����ʽ��ʾΪ�� �� ��
��6����֪NH3��N2��ѹ�µķе�ֱ�Ϊ����33.5��ͣ�195.8�棬�ݴ��Ʋ������������У�������������� �������ʽ�����������䶳���ʵ��� �������ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
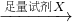 �ⶨʣ�����������
�ⶨʣ����������� �ⶨ����
�ⶨ���� Mg3N2]
Mg3N2]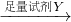 �ⶨ������ɫ��������
�ⶨ������ɫ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com