
【题目】下列物质的保存方法中,错误的是:
A. 氢氟酸要保存在塑料瓶中
B. 新制的氯水要保存在棕色细口瓶中,并放置在阴暗处
C. 少量液溴要保存在带有橡胶塞的棕色细口瓶中,并在液溴上面加水封
D. 单质碘要保存在棕色广口瓶中,并放置在阴凉处
科目:高中化学 来源: 题型:
【题目】现要配制0.1 mol/L的Na2CO3溶液,下列操作导致所配溶液浓度偏高的是
A. 称量时,左盘高,右盘低 B. 定容时俯视容量瓶刻度线
C. 原容量瓶洗净后没有干燥 D. 摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碱性蓄电池在充电和放电时发生的反应为:
Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列说法中正确的是
Fe(OH)2+Ni(OH)2,下列说法中正确的是
A. 放电时,负极上发生反应的物质是Fe
B. 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2
C. 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O
D. 充电时,阳极附近pH值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.甲醇作为一种较好的可再生能源,具有广泛的应用前景。
已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) ![]() CH3OH(g) H1=-90kJ·mol-1
CH3OH(g) H1=-90kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g) + H2(g) H2=-41kJ·mol-1
CO2(g) + H2(g) H2=-41kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:___________________。
Ⅱ. 已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度 | ||
500℃ | 700℃ | 800℃ | ||
2H2(g) + CO(g) | K1 | 2.5 | 0.34 | 0.15 |
H2(g) + CO2(g) | K2 | 1 | 1.7 | 2.52 |
3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应①是__________(填“吸热”或“放热“)反应
(2)观察①②③可推导出K1、K2、K3之间的关系,则K3=_______(用K1、K2表示)
(3)某温度时,反应①式中各物质的平衡浓度符合下式:20×c(CH2OH)=3×c(CO)×c3(H2),试判断此时的温度为____________。
(4)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.4 mol· L-1、1 mol·L-1、0.5 mol·L-1、0.4 mol·L-1molL-1,则此时V(正)______V(逆)(填“>”、 “=”或“<”)。
(5)对应反应③,一定条件下将H2(g)和CO2(g)以体积比3:1置于恒温恒容的密闭容器发生反应,下列能说明该反应达平衡状态的有_____________。
A.体系密度保持不变
B.H2和CO2的体积比保持不变
C.混合气体的平均相对分子量不变时,反应一定达到平衡状态
D.当破坏CO2中2个碳氧双键,同时破坏H2O中的2个氧氢键,反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认识有机物相关问题
(1)有机物 的系统命名为________________。
的系统命名为________________。
(2)有机物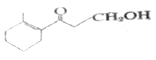 的分子式为_____________。所含的含氧官能团的名称为___________。
的分子式为_____________。所含的含氧官能团的名称为___________。
(3)根据题意,将下列正确的组号填写在空格上
①金刚石与“足球烯”;②氧气(O2)与臭氧(O2)
③16O、17O、18O;④CH4和CH3CH3CH3;
⑤乙烯和乙烷⑥![]() 和
和![]() ⑦
⑦![]() 和
和
⑧D和T⑨ 和
和 ⑩
⑩ 和
和
是同分异构体的是__________________。
(4)有机物A的分子式为C6H12O,其核磁共振氢谱如图A所示。有机物B的分子式为C2H6Br3,核磁共振氢谱如图B所示


A的结构简式为:_____________,B的结构简式为:____________________;
(5)分子式C6H12的化合物有多种同分异构体,其中有一种同分异构体中所有碳原子都在同一平面上,则该烃的结构简式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产和生活中广泛存在。请回答下列有关问题:
(1)氯胺(NH2Cl)是一种长效缓释消毒剂,可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)
△H=+12kJ·mol-1来制取。
![]()
己知部分化学键的键能如上表所示(假定不同物质中同种化学键的键能一样),则a=______。
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g)![]() N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
(b)N2O2(g)+ O2(g)=2N02(g) (慢) Vb正=Kb正c2(N2O2)·c2(O2),Vb逆=Kb逆c2(NO2),△H2<0
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,其平衡常数K=______(用ka正、Ka逆、Kb正、Kb逆表示)。
2NO2(g)达到平衡状态,其平衡常数K=______(用ka正、Ka逆、Kb正、Kb逆表示)。
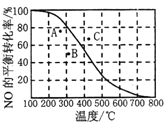
②100KPa时,密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则__点对应的压强最大,原因是______________。
2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则__点对应的压强最大,原因是______________。
③反应2NO(g)+O2(g)![]() 2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)
2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mo1,则此反应对NO的转化率的影响是____(填“增大”、“减小”或“无法判断”)。
2NO(g) △H=+180kJ/mo1,则此反应对NO的转化率的影响是____(填“增大”、“减小”或“无法判断”)。
④某温度下,反应2NO(g)+O2(g)![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将_____(填“正反应方向”、“逆反应方向”或“不”)称动。判断的依据是_____。 (3)工业上可通过电解NO制备NH4NO3,其工作原理如右图所示。①该装置的阳极是_____(填“电极a”、“电极b”)。
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将_____(填“正反应方向”、“逆反应方向”或“不”)称动。判断的依据是_____。 (3)工业上可通过电解NO制备NH4NO3,其工作原理如右图所示。①该装置的阳极是_____(填“电极a”、“电极b”)。
②电解过程总反应的化学方程式为___________。
③若维持电流强度为6A,电解5小时,理论上可制祠NH4NO3的最大质量为_____g。(已知F=96500C/mol,保留小数点后l位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氧元素及其化合物与人类的生产、生活密切相关。
I.氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备气态氯胺(NH2Cl),己知部分化学键的键能:
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/KJmol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
则上述反应的热化学方程式为:__________________。
(2)氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为_____________。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(3)在三个容积均为1L的密闭容器中以不同的氢碳比![]() 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
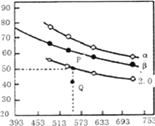
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
①反应的△H______0,氢碳比α____β,Q点v(正)_____v(逆)(填“>”或“<”、“=”)
②若起始时,CO2的浓度分别为0.5mol/L,則P点对应温度度的平衡常数的值为________。
(4)己知:碳酸 H2CO3: K1=4.3×10-7、K2=5.6×10-11;
草酸 H2C2O4: K1=6.0×10-2、K2=6.0×10-5
① 下列微粒可以大量共存的是_______(填字母)。
a.CO32-、HC2O4- b.H2CO3、C2O42- c. C2O42-、HCO3- d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的说法中错误的是
A. 晶体中只要有阴离子就一定有阳离子
B. 原子晶体中共价键越强,熔点越高
C. 晶体中分子间作用力越大,分子越稳定
D. 晶体中不一定存在化学键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com