
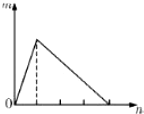
 将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )| A | B | C | D | |
| X | Ba(OH)2 | NaOH | NH3 | HCl |
| Y | 明矾 | AlCl3 | MgSO4 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Ba(OH)2和明矾可生成硫酸钡沉淀;
B.将氢氧化钠酸逐渐加入氯化铝溶液中,先产生沉淀,后沉淀溶解,所用氢氧化钠溶液体积为3:1;
C.氢氧化镁不溶解;
D.将稀盐酸逐渐加入偏铝酸钠溶液中,先产生沉淀,后沉淀溶解,所用稀盐酸溶液体积为1:3.
解答 解:A.Ba(OH)2和明矾可生成硫酸钡沉淀,硫酸钡不溶解,故A错误;
B.将氢氧化钠酸逐渐加入氯化铝溶液中,先产生沉淀,后沉淀溶解,所用氢氧化钠溶液体积为3:1,故B错误;
C.硫酸镁和氨水反应生成氢氧化镁沉淀,氢氧化镁不溶解,故C错误;
D.将稀盐酸逐渐加入偏铝酸钠溶液中,先发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,先产生沉淀,后沉淀溶解,所用稀盐酸溶液体积为1:3,故D正确.
故选D.
点评 本题考查化学反应与图象,明确发生的化学反应与图象的对应关系是解答的关键,要求学生有将化学信息转换为图象信息的能力,同时对化学知识必须十分熟练.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A | 乙醇反应时断键部位 | B | 基团的相互影响 |
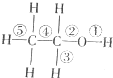 (1)和浓硫酸共热到170℃时②⑤断键 (2)和浓硫酸共热到140℃时只断键② | (1)与钠反应时乙醇比水慢,说明受乙基影响,醇羟基中H原子活泼性减弱 (2)苯酚浊液中加Na0H溶液变澄清,说明受苯环影响,酚羟基中H原子活泼性增强 | ||
| C | 分离提纯 | D | 醇、酚用途 |
| (1)工业乙醇通过蒸馏得无水乙醇 (2)苯中混有苯酚,加溴水沉淀后过滤,除去三溴苯酚沉淀 | (1)甘油加水作护肤剂 (2)酚类化合物有毒,不能用于杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
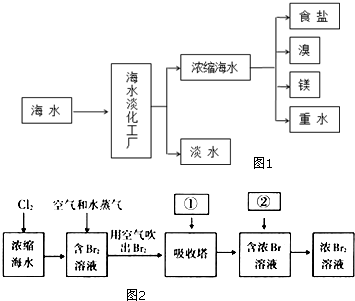 浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ S2- CO32- | B. | AlO21 SO42- MnO4- | ||
| C. | NO3- Cl- SO42- | D. | MnO4- SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 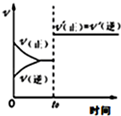 反应CO+NO2?CO2+NO达平衡后,增大压强时反应速率随时间的变化 | |
| B. | 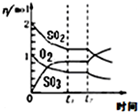 反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 | |
| C. | 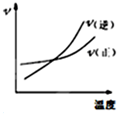 反应N2+3H 2?2NH3△H<0在恒容的容器中,反应速率与温度的关系 | |
| D. | 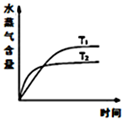 反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,温度分别为T 1、T 2时水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 燃料电池中燃料都在负极发生氧化反应 | |
| C. | Fe3O4俗称铁红,常作红色油漆和涂料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
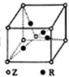 X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:| 元素 | 相关信息 |
| X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
| Y | 原子核外电子有7种不同的运动状态 |
| Z | 地壳中含量最高的元素 |
| W | 价电子排布式为(n+1)sn(n+1)p(n+1) |
| R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
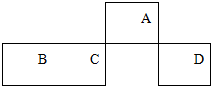 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A的最高价和最低负价的代数和是2.下列判断不正确的是( )| A. | C元素在地壳中的含量仅次于氧元素 | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 元素A与元素B形成的化合物BA是一种新型无机非金属材料 | |
| D. | 实验室可用B的单质与A元素最高价氧化物对应的水化物反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
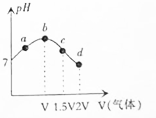
| A. | d点所示溶液中:c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| B. | a点到b点的过程中,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | c点所示溶液中,c(CO32-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com