
某密闭容器中充入等物质的量的气体A和B,一定温度下发生如下反应:A(g)+xB(g) 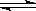 2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度,反应速率随时间的变化关系如图所示。下列说法中正确的是
2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度,反应速率随时间的变化关系如图所示。下列说法中正确的是
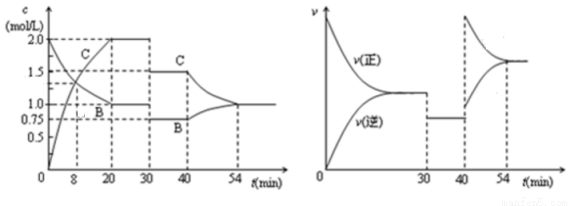
A.8min时表示正反应速率等于逆反应速率
B.前20minA的反应速率为0.05mol/(L·min)
C.反应方程式中的x=1,30min时表示增大压强
D.40min时改变的条件是升高温度,且正反应为吸热反应
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
向容积为2 L的密闭容器中充入2 mol A和1 mol B,在一定条件下发生反应:2A(g) +B(g)  3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是( )
3C(g)经2 s达到平衡后,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是( )
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其它条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷(解析版) 题型:推断题
A、B、C、D、E、F六种短周期主族元素的原子序数依次增大。A是元素周期表中原子半径最小的元素;B元素的原子最外层电子数是次外层电子数的2倍;D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y;D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N;F的最高正化合价为+6。
回答下列问题:
(1)C元素的化学名称为____________,F元素的化学名称为____________。
(2)Y的电子式为____________,M中阴离子的离子符号为___________。
(3)由以上六种元素中的两种原子构成的五核10e-分子的空间构型是______________。
(4)用电子式表示化合物E2F的形成过程为____________________。
(5)D、F的简单氢化物的沸点高低为____________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次段考化学卷(解析版) 题型:填空题
(1)已知:2Al(s)+O2(g)=Al2O3(s) △H=-1644.3kJ·mol-1
2Fe(s)+O2(g)=Fe2O3(s) △H=-815.88kJ·mol-1
写出铝粉与氧化铁粉末发生铝热反应的热化学方程式 。
(2)高铁酸钾(K2FeO4)在水中的反应为4FeO42-+10H2O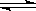 4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。
4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。
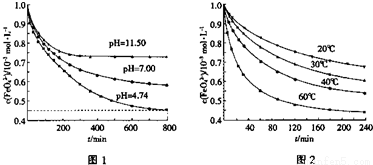
①pH=4.74时,反应从开始到800min时平均反应速率v(OH-)= 。
②图1在800min后,三种溶液中的c(FeO42-)均不再改变。随着pH的变大,此反应的平衡常数K (填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中FeO42-的浓度不再变化,下列说法正确的是
a.上述反应的△H>0 b.升高温度,该反应pH减小
c.温度越高,反应速率越慢 d.加入盐酸,FeO42-的浓度减小
④FeO42-在水溶液中的存在形态如图3所示。下列说法正确的是

A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐变大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O
⑤高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
已知:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是 。
(3)常温常压下,饱和氯水中氯气总浓度约为0.09mol/L,且存在可逆反应:Cl2 + H2O  HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O
HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O HCl+HClO的平衡常数为 。
HCl+HClO的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次段考化学卷(解析版) 题型:选择题
体积相同的盐酸和醋酸两溶液中n(Cl-)=n(CH3COO-)=0.01mol,下列正确的是
A.两种溶液的pH不相同
B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多
C.分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-)
D.它们分别与足量CaCO3反应时,放出的CO2一样多
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次段考化学卷(解析版) 题型:选择题
下列化学方程式中,正确的是
A.甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol
B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-2akJ/mol
2NH3(g) △H=-2akJ/mol
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
D.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年北大附中河南分校高二上第一次月考化学卷(解析版) 题型:填空题
白磷和红磷均能在空气中燃烧,且燃烧产物相同,但二者的燃烧热不同,通过实验可测得这两个反应的反应热。
① P4(s,白磷)+
P4(s,白磷)+ O2(g)===
O2(g)=== P4O10(s) ΔH1=-745.8 kJ·mol-1
P4O10(s) ΔH1=-745.8 kJ·mol-1
②4P(s,红橉)+5O2(g)===P4O10(s) ΔH2=-2954 kJ·mol-1
(1)白磷和红磷的关系是_____________。
a.同一种物质 b.同位素 c.同分异构体 D.同素异形体
(2)红磷的燃烧热是________kJ·mol-1,白磷的燃烧热比红磷的燃烧热___________(填“大”或“小”)。
(3)白磷转化为红磷的热化学方程式为P4(s,白磷)===4P(s,红磷)ΔH=-29.2 kJ·mol-1。在相同的条件下,能量较低的是________(填“白磷”或“红磷”),白磷的稳定性比红磷________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年北大附中河南分校高二上第一次月考化学卷(解析版) 题型:选择题
已知H2(g)+Cl2 (g)===2HCl(g) ΔH=-184.6 kJ·mol-1,则反应:HCl(g)===1/2H2(g)+1/2Cl2(g)的ΔH为( )
(g)===2HCl(g) ΔH=-184.6 kJ·mol-1,则反应:HCl(g)===1/2H2(g)+1/2Cl2(g)的ΔH为( )
A.+184.6 kJ·mol-1 B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1  D.+92.3 kJ·mol-1
D.+92.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017年河北定州中学承智班高二上第一次月考化学卷(解析版) 题型:选择题
对于胃溃疡较重的病人,不适合使用的抑酸剂是( )。
A.Mg(O H)2 B.Al(OH)3 C.NaHCO3 D.Na3C6H5O7·2H2O
H)2 B.Al(OH)3 C.NaHCO3 D.Na3C6H5O7·2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com