
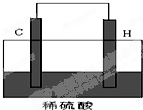
 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J | K |
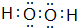
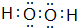
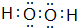 ,
,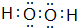 ;
;

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:
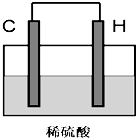 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J |
查看答案和解析>>
科目:高中化学 来源: 题型:

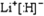
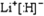
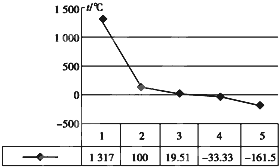
查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源:2015届四川省高一下学期期中考试化学试卷(解析版) 题型:填空题
下表是元素周期表的前三周期,针对表中A~G七种元素填空:
族
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 A
2 B C D
3 E F G
(1)A、B两种元素组成相对分子质量最小的化合物,其分子的空间结构为 。
(2)七种元素中的最高价氧化物对应水化物的酸性最强的是 (用化学式表示,下同);碱性最强的是 ,该化合物属于 。(选填离子或共价化合物),该化合物的电子式为 ,所含化学键类有 、 。
(3)用A、D的单质可以制成燃料电池,电池中装有E的最高价氧化物的水化物的浓溶液作电解质溶液,用多孔的金属惰性电极浸入上述浓溶液中,在X极通入D的单质,Y极通入A的单质,则Y极是该电池的 极(选填正极或者负极),X极的电极反应式是 。当电池中转移1 mol 电子时,消耗A单质的体积为 L(标况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com