
【题目】在下列反应中,HNO3既表现出氧化性,又表现出酸性的是
A.H2S+2HNO3=S↓+2NO2↑+2H2O
B.Cu +4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
C.CuO+2HNO3=Cu(NO3)2+H2O
D.4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】FeCl3、CuCl2混溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是( )
A.加入KSCN的溶液一定不变红色 B. 溶液中一定含Cu2+
C.溶液中一定含有Fe2+ D.剩余固体中一定有铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol/LCH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.将CH3COONa溶液从25℃升温至40℃,溶液中![]() 增大
增大
C.向硝酸中加入氨水至中性,溶液中 <1
<1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届广西省钦州市钦州港区高三12月月考】下列说法不正确的是( )
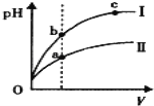
A.等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.25℃ 时,将 a mo1L﹣l 氨水与 0.01 moIL﹣1 盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1﹣),用含a的代数式表示NH3H2O的电离常数Kb= ![]()
C.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的 曲线如图所示。Ⅱ为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
D.已知298K时氢氰酸(HCN)的Ka=4.9×10﹣10、碳酸的Ka1=4.4×10﹣7,Ka2=4.7×10﹣11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法制取氢气,反应速率最大的是( )
A.30℃,块状锌与2 molL-1硫酸溶液反应
B.30℃,粉末状铁与2 molL-1硫酸溶液反应
C.60℃,粉末状锌与2 molL-1硫酸溶液反应
D.60℃,粉末状镁与2molL-1硫酸溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol﹒L-1NaOH溶液分别滴定20.00ml0.100mol﹒L-1的盐酸和醋酸,

A.Ⅰ表示的是滴定盐酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C.V(NaOH)=20mL时,两份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝及其化合物在生产和生活中有着广泛的应用.
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.
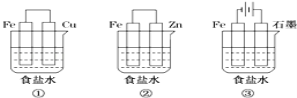
在相同条件下,三组装置中铁电极腐蚀最快的是 (填装置序号),该装置中正极电极反应式为 ;为防止金属Fe被腐蚀,可以采用上述 (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为 。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。电池反应为FePO4 + Li![]() LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向______极移动(填“正”或“负”),负极反应为Li-e— =Li+,则正极反应式为____________。
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电。该电池放电时Li+向______极移动(填“正”或“负”),负极反应为Li-e— =Li+,则正极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com