
| n |
| V |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,1 NA 个CO2分子占有的体积为22.4 L |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、海水中含有溴元素,需经过化学变化才可以得到溴单质 | ||||||||
| B、无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 | ||||||||
| C、从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 | ||||||||
D、从海水中提取镁可以采用下列方法:海水海水
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
| ④ |
| CoSO4溶液 |
| ④ |
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
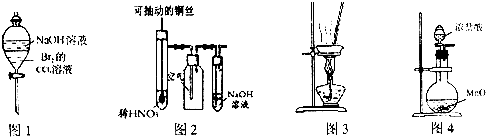
| A、图1装置可以用于除去溶解在CCl4中的Br2 |
| B、图2所示装置微热稀HNO3,在广口瓶中可收集NO气体 |
| C、用图3装置在蒸发皿中灼烧CuSO4?5H2O晶体以除去结晶水 |
| D、实验室常用图4装置制取少量氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com