
| 次数 | 1 | 2 | 3 | 4 |
| 加入氢氧化钠溶液的质量(g) | 25 | 25 | 25 | 25 |
| 生成沉淀的质量(g) | 2.9 | X | 8.7 | 8.7 |
| 8.7g |
| 58g/mol |
| 8.7g |
| 58g/mol |
| 14.25g |
| 20g |


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
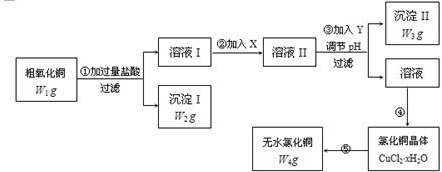
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
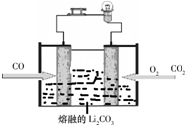 定”).
定”).查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作步骤 | 实验现象 | 实验结论 |
| 取少量滴有酚酞试液的试样于小试管中,滴加足量的 | 溶液由红色褪为无色 且有白色沉淀产生 | 猜想②正确 |
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取少量试样于小试管中,滴加适量的 | 猜想②正确 有关化学方程式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 -OH和
-OH和 CH2OHE.NH2CH2COOH与NH2CH(CH3)COOHF.CH3CHO与CH2=CHCHO.
CH2OHE.NH2CH2COOH与NH2CH(CH3)COOHF.CH3CHO与CH2=CHCHO.查看答案和解析>>
科目:高中化学 来源: 题型:
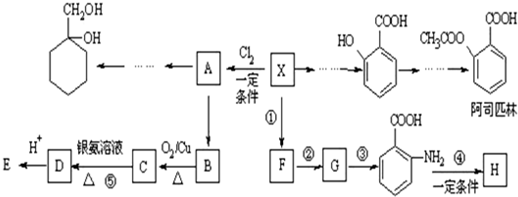
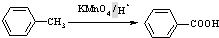
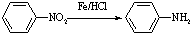 (苯胺,易被氧化)
(苯胺,易被氧化)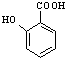 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有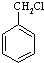 和其他无机物合成
和其他无机物合成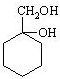 最合理的方案(不超过4步),请在答题纸的方框中表示.例:
最合理的方案(不超过4步),请在答题纸的方框中表示.例: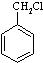
| 反应物 |
| 反应条件 |
| 反应物 |
| 反应条件 |
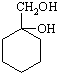
查看答案和解析>>
科目:高中化学 来源: 题型:
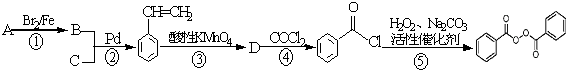
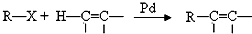
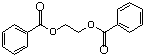 的流程,无机物任选,注明反应条件.
的流程,无机物任选,注明反应条件.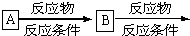
查看答案和解析>>
科目:高中化学 来源: 题型:
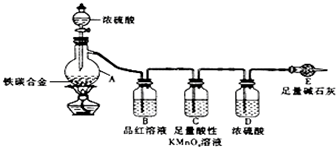
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com