(2011?青岛模拟)Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu
2O
(1)科学研究发现纳米级的Cu
2O可作为太阳光分解水的催化剂.
①在加热条件下用液态肼(N
2H
4)还原新制Cu(OH)
2可制备纳米级Cu
2O,同时放出N
2.当收集的N
2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu
2O的质量为
43.2g
43.2g
;
②一定温度下,在2L密闭容器中加入纳米级Cu
2O并通入0.20mol水蒸气,发生反应:
2H
2O(g)
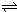
2H
2(g)+O
2(g)△H=+484kJ?mol
-1;测得20min时O
2的物质的量为0.0016mol,则前20min的反应速率v(H
2O)=
8×10-5mol/(L?min)
8×10-5mol/(L?min)
;该温度下,反应的平衡常数表达式K=
;下图表示在t
1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H
2的浓度随时间变化的情况,则t
1时平衡的移动方向为
逆向
逆向
,t
2时改变的条件可能为
增大压强或增大H2浓度
增大压强或增大H2浓度
;若以K
1、K
2、K
3分别表示t
1时刻起改变条件的三个时间段内的平衡常数,t
3时刻没有加入或减少体系中的任何物质,则K
1、K
2、K
3的关系为
K1=K2<K3
K1=K2<K3
;
(2)已知:2Cu
2(s)+O
2(g)=4CuO(s)△H=-292kJ?mol
-1 2C(s)+O
2(g)=2CO(g)△H=-221kJ?mol
-1请写出用足量炭粉还原CuO(s)制备Cu
2O(s)的热化学方程式
2CuO(s)+C(s)=CO(g)+Cu2O(s),△H=+35.5kJ?mol-1
2CuO(s)+C(s)=CO(g)+Cu2O(s),△H=+35.5kJ?mol-1
;
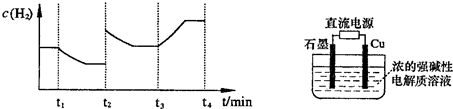
(3)用电解法也可制备Cu
2O.原理如右上图所示,则阳极电极反应可以表示为
2Cu++2OH--2e-=C2u+H2O
2Cu++2OH--2e-=C2u+H2O
.

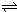 2H2(g)+O2(g)△H=+484kJ?mol-1;测得20min时O2的物质的量为0.0016mol,则前20min的反应速率v(H2O)=
2H2(g)+O2(g)△H=+484kJ?mol-1;测得20min时O2的物质的量为0.0016mol,则前20min的反应速率v(H2O)=
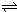 2H2(g)+O2(g)平衡常数的表达式k=
2H2(g)+O2(g)平衡常数的表达式k=
