
某反应过程中能量变化如下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
| A.催化剂能降低反应的活化能 |
| B.催化剂能改变反应的焓变(△H) |
| C.该反应为放热反应 |
| D.正反应的活化能小于逆反应的活化能 |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:单选题
已知H—H键能为436 kJ·mol-1,N—H键能为391 kJ·mol-1,根据化学方程式:N2(g)+3H2(g) 2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )
2NH3(g) ΔH="-92.4" kJ·mol-1,则N≡N键的键能是( )
| A.431 kJ·mol-1 | B.946 kJ·mol-1 |
| C.649 kJ·mol-1 | D.896 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是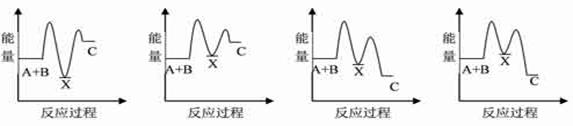
A B C D
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据热化学方程式:S(g)+O2(g) SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
SO2(g) △H=-QkJ·mol-1(Q>0),下列分析正确的是( )
| A.1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量 |
| B.1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
C.S(s)+O2(g) SO2(g) △H<-Q kJ·mol-1 SO2(g) △H<-Q kJ·mol-1 |
| D.1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知断开1 mol H2中的化学键需要吸收436kJ的能量,断开1 mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为
| A.吸收183kJ | B.吸收366kJ | C.放出183kJ | D.放出366kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据碘与氢气反应的热化学方程式
(1) I2(g)+ H2(g) 2HI(g) △H = -9.48 kJ/mol
2HI(g) △H = -9.48 kJ/mol
(2) I2(S)+ H2(g) 2HI(g) △H = +26.48 kJ/mol
2HI(g) △H = +26.48 kJ/mol
下列判断正确的是
| A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(1)的产物比反应(2)的产物稳定 |
| D.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.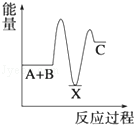 | B.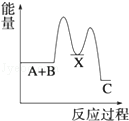 | C.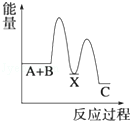 | D.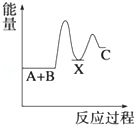 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
| A.H2(g)的燃烧热为571.6 kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
| C.H2SO4(aq)+Ba(OH)2(aq)==BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l)ΔH=+135.9 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
分析图中的能量变化情况,下列表示方法中正确的是( )
| A.2A+B=2C ΔH<0 |
| B.2C=2A+B ΔH<0 |
| C.2A(g)+B(g)=2C(g) ΔH>0 |
| D.2A(g)+B(g)=2C(g) ΔH<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com