


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
 (2006?成都模拟)水的电离平衡曲线如图所示:
(2006?成都模拟)水的电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.c(N
| ||
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关.| C(HCO3-)C(OH-) |
| C(CO32-) |
| C(HCO3-)C(OH-) |
| C(CO32-) |
| 5 |
| 144 |
| 5 |
| 144 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省日照市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体直接排入空气中会引起酸雨的有 。
(2) 可用尿素
可用尿素 还原(尿素中C元素的化合价为+4价),反应的方程式为:
还原(尿素中C元素的化合价为+4价),反应的方程式为: 。当消耗掉12g尿素时,转移电子的物质的量是
。
。当消耗掉12g尿素时,转移电子的物质的量是
。
(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的 ),改流程中发生的主要反应有:
),改流程中发生的主要反应有:

则反应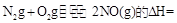 KJ/mol
KJ/mol
(4)CO可用于合成甲醇,反应方程式为 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
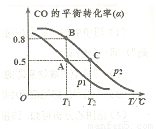
则该反应是 0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为 L。
(5)工业上用氨水将来 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为
;已知25℃时,0.05mol/L(NH4)2SO4溶液的
转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为
;已知25℃时,0.05mol/L(NH4)2SO4溶液的 ,则
,则 =
(用含a的代数式表示,已知
=
(用含a的代数式表示,已知 的电离常数
的电离常数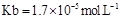 )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com