
18.(12分)在一恒温恒容体积为1 L的容器中存在如下可逆反应:2NO2(g)  N2O4(g),已知NO2、N2O4的消耗速率与本身浓度存在下列关系v(NO2) = k1·c(NO2)2,v(N2O4) = k2·c(N2O4)其中k1、k2反应及温度有关的常数,可以根据上述关系式建立一个速率-浓度的图像如下
N2O4(g),已知NO2、N2O4的消耗速率与本身浓度存在下列关系v(NO2) = k1·c(NO2)2,v(N2O4) = k2·c(N2O4)其中k1、k2反应及温度有关的常数,可以根据上述关系式建立一个速率-浓度的图像如下

试回答下列问题
(1)图中的交点A对应该可逆反应的状态是否达到化学平衡状态?_ 填“是”或“否”)作出判断的理由是_________________
(2)若k1 = k2,则在开始时向该容器中充入1 molNO2,则达到平衡时NO2的浓度为____mol·L-1,N2O4的浓度为___ mol·L-1
(3)若k1≠k2,则在开始时向该容器中充入1 molNO2,设达到平衡时NO2的浓度为c1,N2O4的浓度为c2,则c1与c2的关系为 ,c1、c2、k1、k2存在的关系为______
(1)否;交点处只满足v(NO2)=v(N2O4),而达到平衡时,v(NO2)=2 v(N2O4)
(2)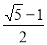 ;
;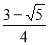
(3)c1+2c2=1mol/L;2k2c2=k1c12
【解析】
试题分析:(1)由图可知,交点A处标志着NO2与N2O4的速率相等,但不代表达到平衡,达到平衡时v(NO2)=2 v(N2O4);(2)当k1=k2时,设N2O4转化了x mol/L,
2NO2(g)  N2O4(g)
N2O4(g)
始 1mol/L 0
转 2x x
平 1-2x x
K=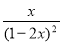 =
= =
=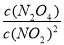 =
=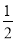 解得x=
解得x=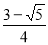 mol/L ;1-2x=
mol/L ;1-2x=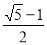 mol/L
mol/L
即N2O4的浓度为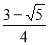 mol·L-1;NO2的浓度为
mol·L-1;NO2的浓度为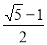 mol·L-1
mol·L-1
(3)当k1≠k2时
2NO2(g)  N2O4(g)
N2O4(g)
始 1mol/L 0
转 1-c1 c2
平 c1 c2
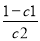 =
=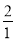 解得2c2=1-c1 即c1+2c2=1mol/L
解得2c2=1-c1 即c1+2c2=1mol/L
 =
=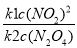 =
=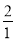 整理后得2k2c2=k1c12
整理后得2k2c2=k1c12
考点:化学平衡的影响因素、化学平衡的计算


科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共10分)
煤焦油中含有多种芳香族化合物,是重要的化工原料。以下是用煤焦油制备均三溴苯的流程。
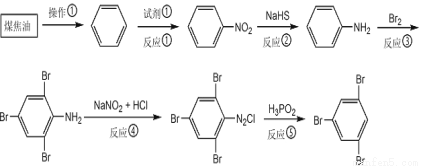
42.操作①的名称是 ;试剂①是 ;反应②中,NaHS作 剂。
43.均三溴苯的系统命名为 。
44.不用硝基苯直接溴化制取均三溴苯,理由是 。指出苯胺比苯更易发生取代反应的二个事实 。
45.苯胺是微溶于水的液体,呈弱碱性。若苯胺中含少量的苯和硝基苯,简述提纯步骤 。
46.氨基与羟基有许多相似的性质,则苯胺与醋酸酐[(CH3CO)2O]在一定条件下反应,除了生成CH3COOH外,
生成的另一种有机物的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省安康市高三上学期第二次教学质量调研化学试卷(解析版) 题型:选择题
下列实验操作不能达到预期目的的是
A.用饱和NaHCO3溶液除去CO2中少量的HCl
B.NH4C1和I2的固体混合物可以用加热的方法分离
C.植物油和水的混合物可以用分液的方法分离
D.溴水中的溴单质可以用四氯化碳萃取
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:填空题
(18分)下图表示的化合物Ⅰ的名称为甲基环氧乙烷,化合物Ⅰ常用于制备药物和合成高分子材料。

(1)化合物Ⅰ的分子式为______________。
(2)化合物Ⅰ在催化剂作用下能与水发生反应得到二元醇,该反应的化学方程式为__________________。
(3)慢心律是一种治疗心律失常的药物,它的合成路线如下:

①Ⅲ+Ⅰ→Ⅳ的反应类型为________;Ⅲ的结构简式为_________________。
②写出化合物Ⅲ与浓溴水反应的化学方程式:______________________。
③由Ⅲ和Ⅰ制备Ⅳ的过程中有少量副产物V生成,V与Ⅳ互为同分异构体,V的结构简式为_______________。
(4)已知: +CH3COOH→
+CH3COOH→ 聚合物
聚合物 可用于制备高吸水性树脂,其单体的结构简式为__________________。以CH3COOH和化合物I为原料可合成该单体,涉及的反应的化学方程式为____________、_____________。
可用于制备高吸水性树脂,其单体的结构简式为__________________。以CH3COOH和化合物I为原料可合成该单体,涉及的反应的化学方程式为____________、_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省滕州市高三12月月考理综化学试卷(解析版) 题型:选择题
.绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的是
A.甲烷与氯气反应制氯仿:CH4+3Cl2  CHCl3+3HCl
CHCl3+3HCl
B.烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2 RCH2CH2CHO
RCH2CH2CHO
C.甲烷、CO合成乙酸乙酯:2CH4+2CO  CH3COOCH2CH3
CH3COOCH2CH3
D.乙烯合成聚乙烯


查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
14.重水D2O的离子积为1.6×10-15,可以用PH一样的定义来规定PD= —lgc(D+),以下关于PD的叙述正确的是
A.中性溶液中PD=7
B.在1LD2O的溶液中溶解0.01mol NaOD(设溶液的体积为1L),其中PD=12
C.在1L D2O中溶解 0.01mol DCl(设溶液的体积为1L),其中PD=2
D.在100mL 0.25mol·L-1的NaOD重水溶液中加入50mL 0.2mol·L-1DCl的的重水溶液,其中PD=1
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
7.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。
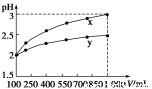
分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列各反应中,划线的反应物能够完全消耗的是
A.溶于水的氯气 B.足量的一氧化碳与氧化铝
C.足量的MnO2与浓盐酸共热 D.足量的铁与浓硫酸共热
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:填空题
(16分)氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)NaH是一种生氢剂,NaH与H2O反应放出H2.NaH含有的化学键为________(填“离子键”或“共价键”),NaH与H2O反应的化学方程式为________________.
(2)写出实验室用锌与稀硫酸反应制取H2的离子方程式:_________.图中三根曲线表示锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系,其中能表示铝的是________(填“a”“b”或“c”).

(3)金属-有机框架物(MOFs)储氢材料是由金属氧化物团簇通过有机高分子链组装形成的晶态材料.MOFs储氢材料比表面积大,空隙率高,储氢容量大,其储氢和放氢的原理可表示为MOFs(s)+nH2(g) (H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).
(H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).
A.低温低压 B.低温高压 C.高温低压 D.高温高压
(4)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2.

已知:H2还原NO生成氮气和水蒸气的热化学方程式是_________________________.
(5)一定条件下,用H2将二氧化碳转化为甲烷的反应如下:
CO2(g) + 4H2(g) CH4(g) + 2H2O(g)
CH4(g) + 2H2O(g)
向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10 min后达到平衡时各物质的浓度分别为: CO2为0.2 mol·L-1, H2为0.8 mol·L-1, CH4为0.8 mol·L-1, H2O为1.6 mol·L-1.
①0~10 min内v(H2)=_______________.
②300℃时上述反应的平衡常数K=___________,若200℃时该反应的平衡常数K=64.8,则该反应的ΔH__________(填“>”或“<”)0.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com