

| 高温高压 |
| 催化剂 |
| ||
| ||
| △ |
| ||
| ||
| △ |
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
| (0.9x)2 |
| 0.1x(y-0.9x) |
| y |
| x |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
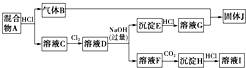
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )
25℃时,在20mL0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,pH的化曲线如图所示,有关粒子浓度关系的较中,不正确的是( )| A、在A点c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、在B点c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、在C点c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| D、在C点c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热时间太短 |
| B、加AgNO3溶液前未用稀HNO3酸化 |
| C、应该和NaOH的乙醇溶液共热 |
| D、不应该冷却后再滴入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
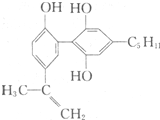 举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂.有一种兴奋剂的结构简式如图,下列有关该物质的说法正确的是( )
举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂.有一种兴奋剂的结构简式如图,下列有关该物质的说法正确的是( )| A、该分子中所有碳原子一定共存于同一平面中 |
| B、1 mol该物质与足量浓溴水反应时,至少消耗4 molBr2 |
| C、该物质属于苯酚同系物,则其遇FeCl3溶液一定显色 |
| D、由于该物质能使酸性KMn04溶液褪色,即可证明其分子必存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若c1=c2,则醋酸溶液中的c(H+)与氢氧化钠溶液中的c(OH-)相同 |
| B、若醋酸溶液的pH=3,氢氧化钠溶液的pH=11,则醋酸溶液中的c(CH3COO-)与氢氧化钠钠溶液中的c(Na+)相同 |
| C、将醋酸溶液与氢氧化钠溶液混合,若c1=c2,则所得溶液的pH=7 |
| D、将醋酸溶液与氢氧化钠溶液混合,若所得混合溶液的pH=7,则混合液中c(CH3COO-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
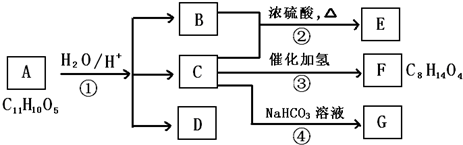
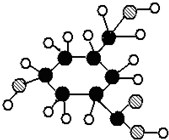
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com