
(14分)工业上可以利用含铝、铁、铜合金的废料获得的绿矾(FeSO4·7H2O)、胆矾等,甲同学设计的实验方案如下:

请回答:
(1)操作①、操作②所用的玻璃仪器是 ;沉淀C的化学式为 。
(2)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选) 。
(3)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(4)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和H2O2制胆矾晶体,则反应④的离子化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L HNO3,欲使3mol Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L。
(14分)
(1)漏斗、烧杯、玻璃棒(全对2分,写一个不得分,写2个1分) Al(OH)3 (2分)
(2)用试管取少量滤液D(1分),向滤液中滴加KSCN(或NaSCN、或NH4SCN),溶液无明显现象(1分),再滴入氯水(或双氧水、或通入Cl2)若变成血红色,则溶液中存在Fe3+(1分)。
(3)铜、铁与稀硫酸形成了原电池(或发生了电化腐蚀,或有电流产生) (2分)
(4)Cu+H2O2+2H+=Cu2++2H2O (2分) 2 (3分)
【解析】
试题分析:(1)操作①、操作②得到滤渣和滤液,所以所用的玻璃仪器是漏斗、烧杯、玻璃棒;合金与NaOH溶液反应,生成Na[Al(OH)4],与CO2反应生成的沉淀C为Al(OH)3。
(2)滤液D可得到绿矾,则滤液D为FeSO4溶液,含有的金属离子为Fe2+,所以检验方案为:用试管取少量滤液D,向滤液中滴加KSCN(或NaSCN、或NH4SCN),溶液无明显现象,再滴入氯水(或双氧水、或通入Cl2)若变成血红色,则溶液中存在Fe3+。
(3)滤渣B中含有活泼性不同的两种金属铁和铜,滴加稀硫酸后,形成原电池,原电池的反应速率大于普通化学反应速率。
(4)滤渣E为金属Cu,加入稀硫酸和H2O2后,发生氧化还原反应,生成CuSO4和H2O,则离子方程式为:Cu+H2O2+2H+=Cu2++2H2O;试剂Y为1mol/L HNO3, 3mol Cu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则反应的离子方程式为:3Cu+8H++2NO3=3Cu2++2NO↑+4H2O,则n(HNO3)=2/3n(Cu)=2/3×3mol=2mol,V(HNO3)=2mol÷1molL1=2L。
考点:本题考查化学流程的分析、基本仪器和基本操作、离子的检验、原电池的应用、化学计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:实验题
(12分)实验室有一包暗红色粉末样品可能是MgCO3、Fe2O3和FeO的混合物。经测定后,结论是不存在FeO。
I.某学生想自己设计实验方案,以证明样品中确实没有FeO。除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液,请你描述实验操作的步骤、实验现象和结论:__________________________________________________。
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测定上述样品中Fe2O3的质量分数,某同学准备用如图所示各仪器 按一定顺序连接成一套完整的装置进行实验,以测定Fe2O3的质量分数。

请回答下列问题:
(1)盛装盐酸的仪器的名称是___________,装置的连接顺序是___________→____________→____________→____________(填图中序号字母,各仪器只能选用一次)。
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是________________________________________________。
(3)为提高测定的准确度,在B中最应加入的物质是下列各项中的_____________(填序号)。
a.饱和NaHCO3溶液 b.蒸馏水
c.浓硫酸 d.NaOH溶液
(4)在进行实验方案评价时,有同学认为不必测定A中沉淀的质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求。实验证明,若用此法测得Fe2O3的质量分数将__________(填“偏大”“偏小”或“不变”之一)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列实验对应的结论不正确的是


A.①能组成Zn-Cu原电池
B.②能证明非金属性Cl>C>Si
C.③能说明 △H<0
△H<0
D.④中自色沉淀为BaS04
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:实验题
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
Ⅰ.查阅材料
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇。
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O
Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O
Ⅱ.制备方法
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
___HCOONa+___Na2CO3+_____ =___Na2S2O4+___CO2+___
=___Na2S2O4+___CO2+___
冷却至40-45℃,过滤,用______洗涤,干燥制得Na2S2O4
Ⅲ.Na2S2O4的性质
(1)Na2S2O4溶液在空气中易被氧化,课题小组测定0.050mol·L-1Na2S2O4溶液在空气中pH变化如右图:

0-t1段主要生成HSO3-,根据pH变化图,HSO3-的电离平衡 水解平衡(填“<”或“>”),课题小组推测Na2S2O4溶液在空气中易被氧化,0-t1发生离子反应方程式为______________,t3时溶液中主要阴离子符号是_________。
(2)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和气体为__________(填化学式)。
请你设计实验验证产物有Na2S2O3存在,完成下表中内容:
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH- NH3↑+H2O
NH3↑+H2O
C.将过量二氧化硫气体通入氨水中:SO2+NH3·H2O=HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++3NO3-=Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮南市高三一模理综化学试卷(解析版) 题型:选择题
一定条件下反应:2A(g)+B(g)  3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
3C(g) ΔH<0,在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | A的浓度 | 平衡常数K |
B | 温度 | 混合气体的密度 |
C | B的物质的量 | A的转化率 |
D | 催化剂的质量 | C的体积分数 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第一次教学质量检测化学试卷(解析版) 题型:填空题
(11分)物质H俗称衣康酸,是制备高效粘合剂等多种精细化学品的重要原料,可经下列反应路线得到:

回答下列问题:
(1)C4H8的名称(系统命名)是 。
(2)反应⑥的化学方程式为 。
(3)衣康酸有多种同分异构体,其中与衣康酸属于同类且核磁共振氢谱有5个峰的有机物结构简式为 。
(4)下列关于H的说法正确的是 (填字母)
a.能使酸性KMnO4溶液或溴的CCl4溶液褪色
b.能与Na2CO3反应,但不与HBr反应
c.能与新制Cu(OH)2反应
d.1molH完全燃烧消耗5molO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第一次教学质量检测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.白色污染是指橡胶造成的污染
B.硫和氮的氧化物是形成酸雨的主要物质
C.汽车尾气的排放是造成温室效应的主要原因
D.含磷洗涤剂的使用是造成水体富营养化的主要原因
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省德镇市高一上学期期末化学试卷(解析版) 题型:选择题
根据下列反应判断有关物质的还原性由强到弱的顺序正确的是
①
②
③
A.
B.
C.
D.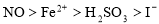
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com