
| A、物质的量:甲<乙 |
| B、气体体积:甲>乙 |
| C、摩尔体积:甲>乙 |
| D、相对分子质量:甲>乙 |
| M |
| Vm |
| m |
| M |
| m |
| M |
| M |
| Vm |
| m |
| M |
| m |
| M |


科目:高中化学 来源: 题型:
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1=△H2 |
| B、△H1>△H2 |
| C、△H1<△H2 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 类别组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
| A | NO2 | CuO | H2SO4 | Ba(OH)2 | Na2S |
| B | CO2 | Na2O2 | CH3COOH | NaOH | NaHCO3 |
| C | SO2 | Al2O3 | HCl | KOH | NaCl |
| D | SO3 | CaO | HNO3 | NH3?H2O | Cu2(OH)2CO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
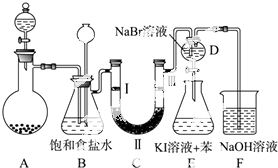 如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8g | B、4.2g |
| C、11.2g | D、5.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com