
【题目】下列对一些实验事实和理论解释正确的是
选项 | 实验事实 | 理论解释 |
A | HCl气体溶于水,能导电 | HCl为离子化合物 |
B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
C |
|
|
D | HF的沸点高于HCl | F的非金属性比Cl强 |
A.AB.BC.CD.D
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】磷酸氯喹是一种古老的抗疟疾和治疗阿米巴病药物种和物,也是一种治疗自身免疫性疾病的药物。2020年2月19日在《新型冠状病毒肺炎诊疗方案(试行第六版)》里面提出新增口服磷酸氯喳作为抗新冠病毒感染治疗用药。其中间体H的一种合成路线如下:
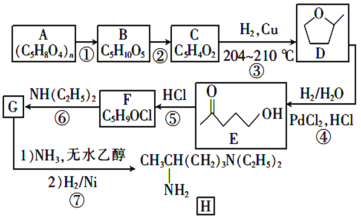
已知:A为半纤维素的一种,属于多糖,B为戊糖, B、C中均含有醛基;C中含有五元环状结构且含一种与D相同的官能团;C中不含碳碳三键。
(1)D中所含官能团的名称是______。
(2)①的反应试剂和条件是________。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,写出B的结构简式,用星号 (*)标出B中的手性碳原子______。
(4)C的结构简式为_______。
(5)⑤的反应类型是________,⑥的化学方程式为________。
(6)化合物W是E的同分异构体,W能发生水解反应,符合题意的W有_____种(不含立体结构),核磁共振氢谱只有两组峰的结构简式是________。
(7)设计以![]() (环氧丙烷)为原料制备
(环氧丙烷)为原料制备![]() 的合成路线(无机试剂任用)______。
的合成路线(无机试剂任用)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H·C·Brown和Schlesinger于1942年在芝加哥大学发现的硼氢化钠(NaBH4)是最常用的还原剂之一,反应常生成偏硼酸钠(NaBO2)。有关实验流程如图所示:
![]()
I.氢化钠的制备:
已知NaH能在潮湿的空气中自燃。甲同学用如图所示装置(每种装置只选一次)来制取NaH。
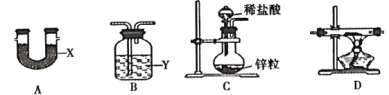
(1)装置的连接顺序是C→____________→D→__________,X、Y分别是__________、__________。
(2)通入H2,点燃装置D处酒精灯之前的实验操作是__________。若省略该操作,可能导致的后果是__________。
Ⅱ.硼氢化钠的制备及纯度测定:
将硼硅酸钠与氢化钠在450~500℃温度和(3.04~5.07)×105Pa压力下反应,生成硼氢化钠和硅酸钠。
(3)乙同学欲通过测定硼氢化钠与稀硫酸反应生成氢气的体积来确定硼氢化钠样品的纯度(杂质只有氢化钠),设计了以下4种装置,从易操作性、准确性角度考虑,宜选装置。__________
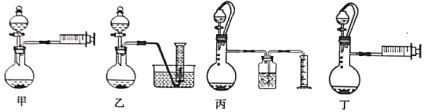
(4)称取4.04g样品(杂质只有氢化钠),重复实验操作三次,测得生成气体的平均体积为9.184L(已折算为标准状况),则样品中硼氢化钠的纯度为__________%(结果保留两位有效数字)。
Ⅲ.碉氢化钠的性质检验:
(5)碱性条件下,丙同学将NaBH4与CuSO4溶液反应可得到纳米铜和NaBO2,其离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若定义pC是溶液中微粒物质的量浓度的负对数。常温下,一定浓度的某酸(H2A)的水溶液中pC(H2A)、pC(HA-)、pC(A2-)随着溶液pH的变化曲线如图所示。
下列说法一定正确的是( )

A.pH=3时,c(H2A)=c(A2-)>c(HA-)
B.c(H2A)+c(HA-)+c(A2-)是定值
C.HA-的水解平衡常数为10-12.7
D.任何时候,溶液中都存在:c(H+)=c(OH-)+c(HA-)+2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在工农业生产中有重要的作用。
(1)P元素有白磷、红磷、黑磷三种常见的单质。
①现代化学中,常利用_______上的特征谱线来鉴定元素。
②白磷(P4)易溶于CS2,难溶于水,原因是_________。
③黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体具有与石墨相类似的层状结构,如下图所示。下列有关黑磷晶体的说法不正确的是_______。
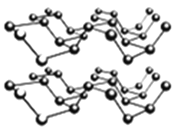
A.黑磷晶体中磷原子杂化方式为sp3杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(2)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化磷和三溴化硼于高温下在氢气中反应合成。磷化硼晶体的晶胞如下图所示,其中实心球为磷原子。
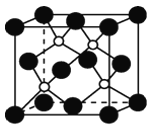
请回答下列问题:
①磷化硼的化学式为_________,该晶体的晶体类型是___________。
②三溴化磷中溴元素基态原子的电子排布式为_________,三溴化硼分子的空间构型是________,合成磷化硼的化学方程式为:___________。
③在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为________,该结构中有一个配位键,提供空轨道的原子是_______。已知晶体中B与P原子的最近距离为a nm,则该晶体的密度的表达式为(不需化简)________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究 Na、Mg、Al的金属性强弱顺序,某课外小组同学进行了如下实验:
实验 步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中; 2将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3将一小段镁带投入稀盐酸中; 4将一小片铝投入稀盐酸中. |
实验 现象 | ①剧烈反应,迅速生成大量的气体 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 ③反应不剧烈,产生无色气体 ④有气体产生,溶液变成红色 |
(1)请在下表中填写与实验步骤对应的实验现象序号:
实验步骤 | 1 | 2 | 3 | 4 |
实验现象 | _____ | _____ | _____ | _____ |
(2)请写出镁与水反应的化学方程式:_______________。
(3)实验结论是___________________。
(4)请你补充该小组同学用原子结构理论对上述实验结论的解释:
同周期元素从左至右原子的电子层数相同,随着核电荷数逐渐增多,原子半径逐渐_______,失电子能力逐渐_______,因此________逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①写出基态Mn原子的价电子排布式为___________________________。在元素周期表中,该元素在________(填“s”“p”“d”“f”或“ds”)区。与Mn同周期的所有过渡元素的基态原子中,最外层电子数与Mn不同的元素有__________种。
②CO32-的空间构型是__________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为___________________________________。
②CO2分子中C原子轨道的杂化类型为________________________________________。
③1 mol甲醛(HCHO)分子中含有的σ键数目为__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com