
分析 (1)TiCl4与水反应生成TiO2和氯化氢;
(2)当CO2:NaOH=1:2时,CO2+2NaOH=H2O+Na2CO3 ,当CO2:NaOH=1:1时,Na2CO3+H2O+CO2=2NaHCO3 ,现在CO2:NaOH=2:3=1:1.5,说明两个反应都要发生,依据反应先后顺序判断产物并书写方程式;
(3)还原性Fe2+>Br-,所以通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,溶液中含有Br-,说明氯气完全反应,Cl2的物质的量为$\frac{67.2L}{22.4L/mol}$=3mol,生成溴离子物质的量为6mol,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=3mol,3molFe2+只能消耗1.5mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,根据电子转移守恒列方程计算x值并书写方程式;
(4)为增强氯水的漂白性,应增大次氯酸的浓度,依据:Cl2Cl2+H2O?HCl+HClO,结合化学平衡移动影响因素解答.
解答 解:(1)TiCl4与水反应生成TiO2和氯化氢,反应的方程式:TiCl4+2H2O═TiO2+4HCl,
故答案为:TiCl4+2H2O═TiO2+4HCl;
(2)当CO2:NaOH=1:2时,CO2+2NaOH=H2O+Na2CO3 ,当CO2:NaOH=1:1时,Na2CO3+H2O+CO2=2NaHCO3 ,现在CO2:NaOH=2:3=1:1.5,说明两个反应都要发生,现在CO2:NaOH=2:3=1:1.5,说明两个反应都要发生:首先1.5molCO2与3molNaOH反应生成1.5molNa2CO3,然后剩下的0.5molCO2与0.5molNa2CO3反应生成1molNaHCO3,剩下1molNa2CO3,总反应是2molCO2与3molNaOH反应生成1molNaHCO3和1molNa2CO3,
离子方程式:2CO2+3OH-=HCO3-+CO32-+H2O;
故答案为:2CO2+3OH-=HCO3-+CO32-+H2O;
(3)还原性Fe2+>Br-,所以通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,溶液中含有Br-,说明氯气完全反应,Cl2的物质的量为$\frac{67.2L}{22.4L/mol}$=3mol,生成溴离子物质的量为6mol,若Br-没有反应,则n(FeBr2)=0.5n(Br-)=3mol,3molFe2+只能消耗1.5mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=6mol,参加反应的n(Br-)=(2x-6)mol,根据电子转移守恒有x×1+[2x-6]×1=3mol×2,解得x=4 mol,方程式:4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-,
故答案为:4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-;
(4)为增强氯水的漂白性,应增大次氯酸的浓度,Cl2Cl2+H2O?HCl+HClO,应使平衡正向移动,且次氯酸浓度增大,
A.氢氧化钠能够与次氯酸反应,消耗次氯酸所以导致漂白性减弱,故A不选;
B.碳酸钙能与盐酸反应,消耗氯化氢,平衡正向移动,次氯酸浓度增大,漂白性增强,故B选;
C.二氧化硫能够与次氯酸反应,消耗次氯酸所以导致漂白性减弱,故C不选;
D.NaHCO3固体能够与盐酸反应,消耗氯化氢,平衡正向移动,次氯酸浓度增大,漂白性增强,故D选;
故选:BD.
点评 本题为综合题,考查了化学方程式的书写,化学平衡移动影响因素,明确反应实质是解题关键,注意反应物用量对反应的影响,题目难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3和 MgO 的熔点均很高,可用于制作耐高温材料 | |
| B. | 将“地沟油”制成肥皂,可以提高资源的利用率 | |
| C. | 小苏打和氢氧化铝胶囊,可以作内服药治疗胃酸过多 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O=H2CO3+OH- | |
| B. | HSO3-+H2O?SO32-+H3O+ | |
| C. | 熔融的NaHSO4电离:NaHSO4=Na++HSO4- | |
| D. | Al(OH)3=H++AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
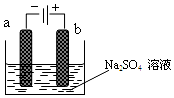 如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )
如图为电解稀Na2SO4水溶液的装置,通电后,石墨两极附近分别滴加几滴酚酞溶液,下列有关说法不正确的是( )| A. | a电极附近呈红色,b电极附近无明显变化 | |
| B. | 逸出气体的体积,a电极的大于b电极的 | |
| C. | Na2SO4水溶液浓度逐渐增大 | |
| D. | 当电路中通过0.04mol e-时,a电极逸出气体的体积为448mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
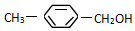 类别醇类或芳香醇.官能团的结构简式-OH名称羟基.
类别醇类或芳香醇.官能团的结构简式-OH名称羟基.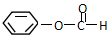 类别酯类.官能团的结构简式-COOC-名称酯基.
类别酯类.官能团的结构简式-COOC-名称酯基.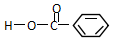 类别羧酸或芳香酸.官能团的结构简式-COOH名称羧基.
类别羧酸或芳香酸.官能团的结构简式-COOH名称羧基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5molC3H8分子中所含C-H共价键数为2NA | |
| C. | 标准状况下,22.4L乙醇完全燃烧所消耗的氧气分子数为3NA | |
| D. | 1molCH5+离子所含的电子数为11NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com