
 已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.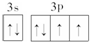 ;非金属性Cl>S>Si,故最高价氧化物对应的水化物中酸性最强的水化物是HClO4,
;非金属性Cl>S>Si,故最高价氧化物对应的水化物中酸性最强的水化物是HClO4, ;HClO4;
;HClO4;| 1 |
| 4 |
| 1 |
| 8 |
| 206 |
| NA |
| 3 |
| ||||
| 3 |
| ||
| 3 |
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体,E为淡黄色的固体.它们之间有如下转化关系:
如图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体,E为淡黄色的固体.它们之间有如下转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁溶于足量的稀硝酸,溶液变黄:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
| B、NaHSO4溶液与NaOH溶液混合:OH-+H+=H2O |
| C、NH4HCO3溶液与足量KOH浓溶液共热:NH4++OH-?NH3↑+H2O |
| D、Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| B、钢铁在潮湿的环境下发生吸氧腐蚀的正极反应:O2+4e-=2O2- |
| C、足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl- |
| D、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol硫酸钾中阳离子所带的正电荷数为6.02×1023 |
| B、1L 0.1mol?L-1 AlCl3溶液中含有0.1×6.02×1023个Al3+ |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为6.02×1023 |
| D、H2O2催化分解生成0.2mol O2时转移电子的数目为0.8×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com