

分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Al、⑥为S、⑦为Cl、⑧为Cu、⑨为Fe
(1)d区元素包含周期表中3-10列元素;元素⑧位于第四周IB族;
(2)N和Cl形成的常见化合物有NCl3,为分子晶体;与NH3分子相似,空间构型为三角锥形;中心原子杂化方式为sp3
(3)s能级最多容纳2个电子,且p能级容纳电子,故n=2,则该元素为N元素,氨气和水都是极性分子,相似相溶原理,又由于氨分子与水分子间可形成氢键;
(4)C、N形成的化合物为C3N4,由其超硬,耐高温等性质,可判断该化合物属于原子晶体,由于C-N键比C-C键短,C-N键键能更大,其熔点更高;
(5)Al的氧化物为Al2O3,S的最高价氧化物的水化物为H2SO4,二者反应生成硫酸铝与水.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Al、⑥为S、⑦为Cl、⑧为Cu、⑨为Fe
(1)属于d区的是Fe为⑨号元素,⑧为Cu元素,位于第四周IB族,Cu的外围电子排布为3d104s1,故答案为:Fe;3d104s1;
(2)N和Cl形成的常见化合物有NCl3,为分子晶体;与NH3分子相似,空间构型为三角锥形;中心原子杂化方式为sp3,故答案为:分子晶体;三角锥形;sp3;
(3)s能级最多容纳2个电子,且p能级容纳电子,故n=2,则该元素为N元素,即为③号元素,氨气和水都是极性分子,根据相似相溶原理可知NH3易溶于水,又由于氨分子与水分子间可形成氢键,使NH3更易溶于水,故答案为:③;氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键;
(4)C、N形成的化合物为C3N4,由其超硬,耐高温等性质,可判断该化合物属于原子晶体,由于C-N键比C-C键短,C-N键键能更大,C3N4熔点更高,故答案为:C3N4;高;
(5)Al的氧化物为Al2O3,S的最高价氧化物的水化物为H2SO4,二者反应的方程式为:Al2O3+6H+═2Al3++3H2O,故答案为:Al2O3+6H+═2Al3++3H2O.
点评 本题考查元素周期表与元素周期律、分子结构与性质、晶体类型与性质等,需要学生熟练掌握元素周期表的结构,侧重考查学生对知识的迁移应用,难度中等


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1gH2 | B. | 11gCO2 | C. | 8gO2 | D. | 4.5gH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1所示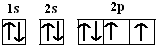 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素是生物生长发育和新陈代谢所必需的物质 | |
| B. | 按溶解性的不同,维生素可分为脂溶性维生素和水溶性维生素两类 | |
| C. | 缺乏维生素A易患甲状腺肿大 | |
| D. | 缺乏维生素C易患坏血病 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止Fe2+水解,Fe(NO3)2溶液需要加酸酸化 | |
| B. | 该反应中氧化剂与还原剂物质的量之比为8:1 | |
| C. | 若有1molNO3-发生氧化反应,则转移电子5mol | |
| D. | 该反应中Fe2+是还原剂,NH4+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol | B. | 3 mol | C. | 5 mol | D. | 6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1 mol莽草酸完全燃烧消耗156.8 L O2 | |
| B. | 1 mol莽草酸最多与4 mol Na发生反应 | |
| C. | 莽草酸能使溴的四氯化碳溶液褪色 | |
| D. | 莽草酸可发生聚合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com