
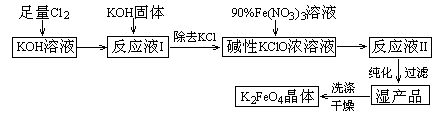
| A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供反应物 |
| D.使副产物KClO3转化为 KClO |
 2NaOH + H2↑ + Cl2↑(2分)
2NaOH + H2↑ + Cl2↑(2分)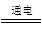 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑

科目:高中化学 来源:不详 题型:单选题
| A.硬水中的Ca2+、Mg2+可与肥皂的主要成分结合而生成沉淀,从而浪费肥皂 |
| B.凡含有Ca2+、Mg2+离子的水都是硬水 |
| C.水的硬度是用CaO的量为标准的 |
| D.1 L水中含10 mg CaO(或相当于10 mg CaO)称为1度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学是一门以实验为基础的自然科学 |
| B.化学家可以制造出自然界中不存在的物质 |
| C.物质发生化学反应都伴随着能量变化 |
| D.化学研究会造成严重的环境污染,人类终将毁灭在化学物质中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
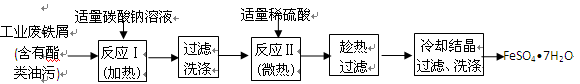
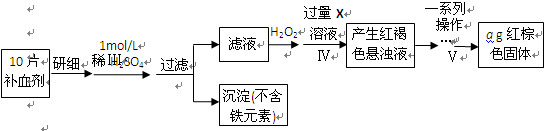
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
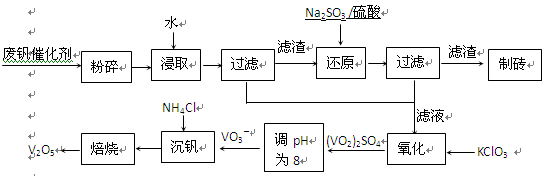
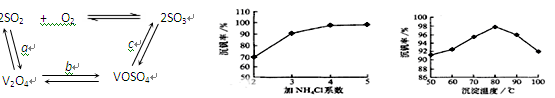
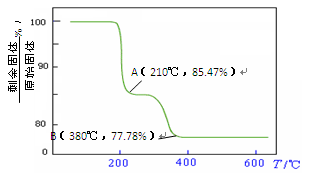
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
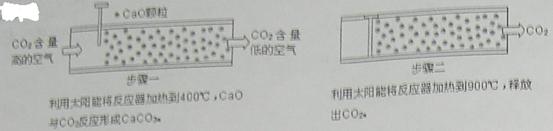
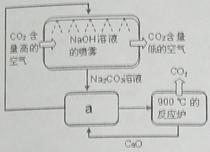
| A.KNO3溶液 | B.CaCl2溶液 | C.CuSO4溶液 | D.Na2CO3溶液 |
| A.①③ | B.①② | C.②④ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
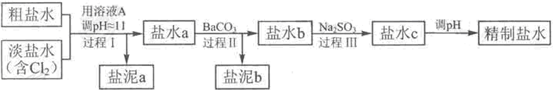
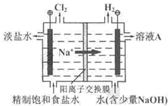
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学的主要特点是在原子、分子水平上认识物质 |
| B.化学可以识别、改变和制造分子 |
| C.现代量子化学理论使化学研究完全摆脱了繁琐的化学实验 |
| D.化学科学为环境问题的解决提供了有力的保障 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com