
某同学用下列装置制备并检验Cl2的性质。
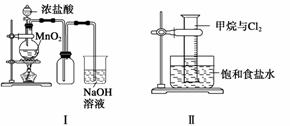
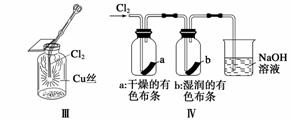
下列说法正确的是 ( )
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:发生的反应不是燃烧反应
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强
B.陶瓷、玻璃、水泥容器都能贮存氢氟酸
C.石灰抹墙、水泥砌墙的硬化过程原理相同
D.玻璃窑中出来的气体的主要成分是二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中几种常见物质的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。

已知:A、B、C、D是单质,其余是化合物,其中B、D是常见金属,且组成B的元素属于过渡元素。又知A在C中点燃有苍白色火焰,M既可溶于盐酸又可溶于NaOH溶液。请回答下列问题:
(1)W的电子式是__________________。
(2)写出N的化学式:________,并任写一种N的主要用途:_____
_________________________________________________________。
(3)写出下列反应的离子方程式:
反应①_______________________________________________。
反应③_______________________________________________。
K溶液和过量氨水反应_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是______________________________________。
(2)验证氯气的氧化性强于碘的实验现象是__________________________________。
(3)B中溶液发生反应的离子方程式是______________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_________________________
________________________________________________________________________。
(5)过程Ⅲ实验的目的是_______________________ ___________________________。
___________________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____________________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生 成NaBr、NaBrO
成NaBr、NaBrO 3等
3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是为了避免__________________。
(2)Br2可用热空气吹出,其原因是_________________________________________。
(3)写出步骤③所发生的化学反应方程式____________________________________。
用硫酸而不用盐酸酸化的原因可能是________________。步骤②的产品有时运输到目的地后再酸化,主要是因为___________________________________________________
________________________________________________________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中___________________________。
a.通入HBr b.加入Na2CO3溶液
c.加入NaBr溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示。

下列说法中不正确的是 ( )
A.用淀粉KI试纸和食醋检验加碘盐时淀粉KI试纸会变蓝
B.足量Cl2能使湿润的、已变蓝的淀粉KI试纸褪色的原因可能是5Cl2+I2+6H2O===2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO
D.途径 Ⅱ 中若生成1 mol I2,则反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中Y所处的周期序数与主族序数之和为8。下列说法错误的是
A.Z元素的氧化物对应水化物的酸性一定弱于W
B.四种元素中Z的原子半径和形成的离子半径均最大
C.X、Z、W中最简单气态氢化物稳定性最弱的是Z
D.X、Y、Z的原子均能与氢原子形成四原子分子
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
A.产生气体的体积:①>②
B.①的溶液复原可向电解后的溶液中加氯化铜;②中电解后溶液的pH不变
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极2Cl- -2e- = Cl2↑
②中负极 2H+ + 2e- = H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种短周期元素在周期表中的位置如右图,X通过共用三对电子形成X2分子,下列说法不正确的是( )
A.化合物XZ3中各原子均满足8电子的稳定结构
B.X、Y、Z三种元素形成的含氧酸都是强酸
C.常温下,Z单质可与Y的氢化物发生置换反应
D.一定条件下,X2与Al反应得到AlX

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com