
| A. | 摩尔是化学上常用的一个物理量 | |
| B. | 用托盘天平称取25.20 gNaCl | |
| C. | 配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 | |
| D. | 某物质含有6.02×1023个微粒,含有这个数目微粒的物质不一定是1 mol |
分析 A.摩尔是物质的量的单位;
B.托盘天平的精确度为0.1g;
C.定容时俯视刻度线,所配溶液的体积偏小,浓度偏大;
D.一种物质的分子由若有多个微粒构成,则不对.
解答 解:A.摩尔是物质的量的单位,不是物理量,故A错误;
B.托盘天平的精确度为0.1g,用托盘天平可以称取25.2 gNaCl,故B错误;
C.定容时俯视刻度线,所配溶液的体积偏小,浓度偏大,故C错误;
D.一个氢气分子中含有2个氢原子,含有6.02×1023个氢原子的氢气的物质的量为$\frac{6.02×10{\;}^{23}}{6.02×1{0}^{23}mol{\;}^{-1}}$×$\frac{1}{2}$=0.5mol,故D正确;
故选D.
点评 本题考查了物质的量的计算和实验仪器及操作,难度不大,重点掌握一定物质的量浓度溶液配制过程中的误差分析.


科目:高中化学 来源: 题型:选择题
| A. | 镁粉中含少量铝粉:加足量氢氧化钠溶液充分搅拌后过滤 | |
| B. | 碳酸钠溶液中含少量碳酸氢钠:加足量澄清石灰水 | |
| C. | 自来水中含少量Fe3+:蒸馏 | |
| D. | 硝酸钾固体中含少量氯化钾:配制80℃的饱和溶液,冷却、结晶、过滤、洗涤干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO中有少量的NO2:通过装有水的洗气瓶 | |
| B. | SO2中混有少量HCl气体:通过饱和NaHSO3溶液洗气 | |
| C. | O2中有少量的CO2:通过装有碱石灰的U形管 | |
| D. | 食盐中有少量的NaHCO3:加过量的烧碱溶液后加热蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03molNO、0.01molNO2 | B. | 0.03molNO2、0.01molNO | ||
| C. | 0.06molNO | D. | 0.03molNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L pH=1的HCl溶液中,H+个数为0.1NA | |
| B. | 8.4gNaHCO3溶于水,溶液中含有0.1NA个CO32- | |
| C. | 标准状况下,11.2 L四氯化碳中含有的C-Cl键的数目为2NA | |
| D. | 电解精炼铜时,理论上阳极质量每减少64g,则外线路通过电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
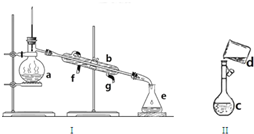 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置查看答案和解析>>
科目:高中化学 来源: 题型:解答题
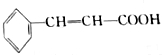 也存在反式结构,1mol
也存在反式结构,1mol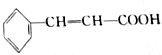 最多可以与4molH2发生加成反应.
最多可以与4molH2发生加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
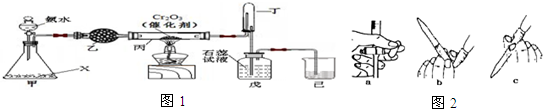
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com