
N2(g)+3H2(g) ![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0

请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)= _________∶_________。在15分钟时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为_________________________。
(2)在t1时,曲线发生变化的原因是__________________、__________________。请计算氢气在t1起点时的坐标(_________,_________)以及在t2平衡时的坐标(_________,_________)。并在图中画出在t1—t2之间氢气的物质的量变化曲线。
(3)为达到图示中t2的平衡状态,在t1—t2之间需要采取的措施是_________。
a.扩大容器的体积
b.升高温度
c.降低温度
d.缩小容器的体积
(4)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)= _________∶_________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)= _________∶_________。
(5)根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2)∶n(H2)=_________。
(1)1 3.3
0.02 mol·L-1·min-1
(2)分离氨气、补充物质的量之比为n(N2)∶n(H2)=1∶3.3的氮气和氢气 25 3.33 50 3.03
(3)a、b
(4)n(N2)∶n(H2) 3 11
α(N2)∶α(H2)=11∶10
(5)1∶3
图象

解析:(1)由图知n(N2)∶n(H2)=1∶3.3
![]()
(2)由图象的变化趋势知,分离NH3,并按比例补充反应混合气体,
坐标求算:N2 — 3H2
1 3
0.1 mol n(H2)
n(H2)=0.33 mol
所以t1时,n(H2)=3.0 mol+0.33 mol=3.33 mol,坐标(25,3.33)。
50 min平衡时,n(N2)减少0.1 mol,所以n(H2)减少0.3 mol,坐标(50,3.03)。
(3)从影响平衡的因素考虑,选ab。
(4)循环推算n(N2)∶n(H2)=3∶11,转化率=![]() =1∶3。
=1∶3。
(5)据(2)(4)数据,知最佳原料比1∶3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第6期 总第162期 人教课标版(选修4) 题型:058
在实验室中进行合成氨工业的模拟实验,当反应进行一段时间,并建立相应的平衡以后,及时分离出氨并补充与起始原料比相同的氮气和氢气,以实现连续的生产过程,在
1 L的密封容器中,一定条件下会发生如下反应:N2(g)+3H2(g)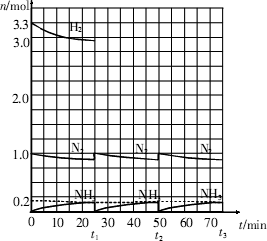
请根据上图所示回答下列问题:
(1)在t1时,曲线发生变化的原因是________.请计算氢气在t1起点时的坐标(________,________)以及在t2平衡时的坐标(________,________).
(2)经历十次上述循环过程后,在t11达到平衡时,N2和H2的物质的量之比为n(N2)∶n(H2)=________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中进行合成氨工业的模拟实验,当反应进行一段时间并建立平衡以后,及时分离出氨并补充与起始原料比相同的氮气和氢气,以实现连续的生产过程,一定条件下在1L的密闭容器中发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH<0
2NH3(g);ΔH<0
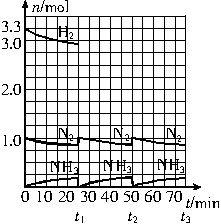
请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)=______。在15min时合成氨反应第一次达到平衡,以这段时间内H2的浓度变化表示的平均化学反应速率为________。
(2)在t1时,曲线发生变化的原因是_________________、________________。请计算氢气在t1起点时的坐标(_______,______)以及在t2平衡时的坐标(____,____)。
(3)为达到图示中t2时的平衡状态,在t1~t2之间需要采取的措施是___________________。
A.扩大容器的容积 B.升高温度 C.降低温度 D.缩小容器的容积
(4)经历十次上述的循环过程,计算在t11平衡时,N2和H2的物质的量之比n(N2)∶n(H2)=_____________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
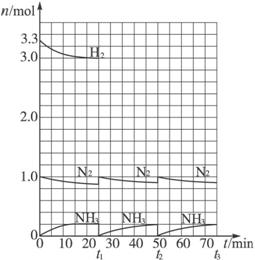
请根据图示回答下列问题:
(1)反应起始时,氮气与氢气的物质的量之比n(N2)∶n(H2)=___________。在25 min时合成氨反应第一次达到平衡,其间以H2的浓度变化所表示的平均化学反应速率为_________。
(2)在t1时,曲线发生变化的原因是_______________、_______________。请计算氢气在变化后t1起点时的坐标(___________,___________)以及在t2平衡时的坐标(___________,___________)。
(3)经历十次上述的循环过程,计算在t11达到平衡时,N2和H2的物质的量之比n(N2)∶n(H2)=___________,整个过程中N2和H2的总转化率之比α(N2)∶α(H2)=___________。
(4)根据以上计算结果,请你建议合成氨反应的最佳原料比是:n(N2)∶n(H2)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 2NH3(g);ΔH<0。请根据图示回答下列问题:
2NH3(g);ΔH<0。请根据图示回答下列问题: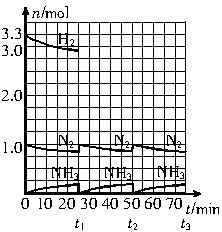
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com