
氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) 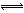 Fe3O4(s)+4H2(g)
△H=akJ/mol (I)
Fe3O4(s)+4H2(g)
△H=akJ/mol (I)
2Fe3O4(s) 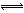 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
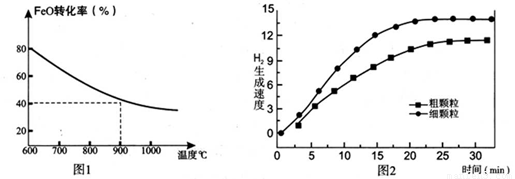
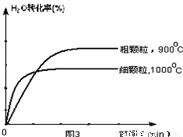
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。
(1)反应:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反 应II可采用的方案是: ;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时 H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
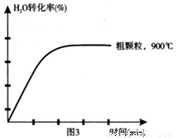
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
(16分)(1)(2a+b)kJ/mol(2分)(无kJ/mol或“2a+b kJ/mol”扣1分,其他不给分)
(2)用廉价的清洁能源供给热能(2分)(答用“太阳能”、“风能”、“地热能”、“生物能”、“核能”供给热能给3分;答“加热”、“升高温度”等均不给分)
(3)①细颗粒FeO表面积大,与H2的接触面积大,反应速率加快(3分) (“增大接触面积,加快反应速率”、“接触面积越大,反应速率越快”等合理表述给3分;答“增大反应物浓度”、“FeO的量增加,反应速率加快”给1分); ②相等(2分)(答“等于”、“=”给1分)
③(4分)解:900℃时,达到平衡时FeO转化的量为:n(FeO)=0.60mol×40%=0.24mol
H2O(g)+3FeO(s)  Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
起始物质的量(mol) 0.20 0.60 0 0
变化物质的量(mol) 0.080 0.24 0.080 0.080
平衡物质的量(mol) 0.12 0.36 0.080 0.080 (2分)
由于固体物质的浓度是常数,不能写入平衡常数表达式,气体物质的浓度可以变化,根据c=n/V可求平衡时氢气和水蒸气的物质的量浓度,则K=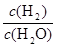 =
=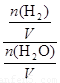 =
= =0.67(2分)
=0.67(2分)
(4)(3分)
【解析】
试题分析:(1)先对已知热化学方程式编号为①②,观察发现①×2+②可得,2H2O(g)=2H2(g)+O2(g),其焓变=①的焓变×2+②的焓变=(2a+b)kJ/mol;(2)b>0,说明反应II是吸热反应,可用用廉价的清洁能源供给热能或用“太阳能”、“风能”、“地热能”、“生物能”、“核能”供给热能;(3)①FeO是反应I中的固体反应物,细颗粒FeO表面积大,与H2的接触面积大,反应速率加快(或“增大接触面积,加快反应速率”、“接触面积越大,反应速率越快”等);②由于固体物质浓度是常数,FeO的用量和浓度保持不变,将粗颗粒FeO改为细颗粒FeO,只能加快反应速率,不能使平衡移动,因此H2O(g)的平衡转化率不变或相等;③解:900℃时,达到平衡时FeO转化的物质的量量为:n(FeO)=0.60mol×40%=0.24mol,则:
H2O(g)+3FeO(s)  Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
起始物质的量(mol) 0.20 0.60 0 0
变化物质的量(mol) 0.080 0.24 0.080 0.080
平衡物质的量(mol) 0.12 0.36 0.080 0.080
由于固体物质的浓度是常数,不能写入平衡常数表达式,气体物质的浓度可以变化,根据c=n/V可求平衡时氢气和水蒸气的物质的量浓度,则K=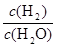 =
=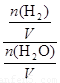 =
= =0.67;
=0.67;
(4)观察图1可得:随着温度的升高,FeO的平衡转化率减小,前者导致平衡向吸热方向移动,后者说明平衡向逆反应方向移动,因此逆反应是吸热反应,则反应I的正反应是放热反应;其他条件保持不变时,900℃→1000℃就是升高温度,既能加快反应速率,又能使平衡向逆反应方向移动,则H2O(g)的转化率由0逐渐增大,知道达到平衡,1000℃时达到平衡的时间比900℃时少,1000℃时H2O(g)的平衡转化率比900℃时小,由此可以画出水蒸气的转化率随温度变化的示意图。
考点:考查化学反应原理,涉及盖斯定律、常见的能量转化形式、固体反应物颗粒粗细对反应速率和平衡移动的影响、化学平衡常数的计算、温度对反应速率和平衡移动的影响图像等。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
氢是一种理想的绿色能源,最近科学家利用太阳光分解水来制备氢。下图为光分解水制氢的循环系统,反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用。
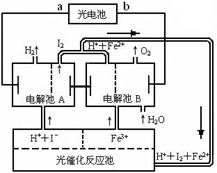
①判断光电池的a端为_________极,b端为________极。
②写出电解池A中电极反应式:
阴极______________________________,
阳极______________________________。
③电解池B中反应的离子方程式__________________________________________。
④若电解池A中生成H2的体积为8.96L(标准状况下),则电解池B中生成Fe2+的物质的量为____________________。
查看答案和解析>>
科目:高中化学 来源:2007-2008学年山东省莱芜市高三(上)期末化学试卷(解析版) 题型:解答题
 H2(g)+
H2(g)+ F2(g)=HF(g);△H=-269kJ?mol-1
F2(g)=HF(g);△H=-269kJ?mol-1 O2(g)=H2O(g);△H=-242kJ?mol-1
O2(g)=H2O(g);△H=-242kJ?mol-1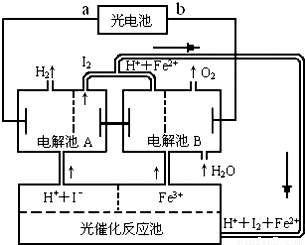
查看答案和解析>>
科目:高中化学 来源:2011年浙江省高考化学模拟试卷(二十)(解析版) 题型:解答题
 H2(g)+
H2(g)+ F2(g)=HF(g);△H=-269kJ?mol-1
F2(g)=HF(g);△H=-269kJ?mol-1 O2(g)=H2O(g);△H=-242kJ?mol-1
O2(g)=H2O(g);△H=-242kJ?mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com