
| A.Zn+H2SO4(稀) | B.NaCl+AgNO3(溶液) |
| C.H2+O2 | D.Na2O+H2O |
科目:高中化学 来源:不详 题型:单选题
| A.银离子 | B.亚铁离子 | C.镁离子 | D.铝离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
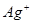 、
、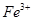 、
、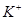 、
、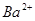 、
、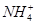 等阳离子。某同学进行如下实验:
等阳离子。某同学进行如下实验: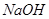 溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
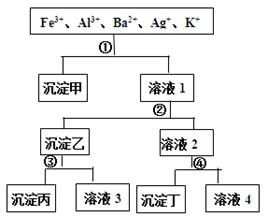
| A.沉淀乙是氢氧化铝和氢氧化银的混合物 |
| B.溶液3中含有Al3+ |
| C.溶液4含有三种阳离子,分别是H+、Na+、K+ |
| D.试剂①是NaCl,试剂④是H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.Na2SiO3与Na2CO3的混合溶液 |
| B.Na2S和Na2SO3的混合溶液 |
| C.NaAlO2与Na2SiO3的混合溶液 |
| D.Na2SO3与Na2SiO3的混合溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com