
分析 (1)反应Ⅰ的热化学方程式可以依据反应Ⅱ、Ⅲ热化学方程式计算得到,同时得到反应的焓变;
(2)反应Ⅱ:NH2COONH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1是气体探究增大的吸热反应,熵变△S>0,焓变△H>0,反应自发进行的判断依据是△H-T△S<0;
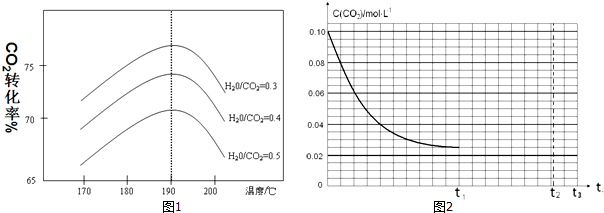
(3)①不同水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$和温度影响CO2平衡转化率变化的趋势曲线分析可知,
②反应Ⅲ是放热反应,升温平衡逆向进行;
(4)依据热化学方程式2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=a kJ•mol-1 ,结合平衡常数的概念书写;平衡常数只受温度影响,结合绝热容器中温度变化,判断平衡移动方向,再判断平衡常数的变化;
(5)图象分析二氧化碳的平衡浓度为0.025mol/L,体积缩小一半浓度增大一倍应为0.05mol/L,随反应进行达到平衡状态,因为生成物为固体,最后达到相同平衡状态,二氧化碳浓度不变,据此画出变化曲线;
(6)分析尿素结构可知,和羰基连接的氨基据此性质分析推断.
解答 解:(1)反应Ⅰ:2NH3(g)+CO2(g)?NH2COONH4(s)△H1=akJ•mol-1
反应Ⅱ:NH2COONH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1
总反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1
依据盖斯定律计算反应Ⅰ+反应Ⅱ得到:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=akJ•mol-1+72.49kJ•mol-1=-86.98kJ•mol-1
a=-159.47akJ•mol-1,
故答案为:-159.47;
(2)反应Ⅱ:NH2COONH4(s)?CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1是气体探究增大的吸热反应,熵变△S>0,焓变△H>0,反应自发进行的判断依据是△H-T△S<0,则满足此关系应是高温条件下,反应自发进行,
故答案为:>,高温;
(3)①反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大,故答案为:降低;
②反应Ⅲ:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1,是放热反应,升温高于190°C,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行,
故答案为:温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低;
(4)反应Ⅰ:2NH3(g)+CO2(g)?NH2CO2NH4(s)△H1=-159.47kJ•mol-1,平衡常数K=$\frac{1}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$;反应若在绝热容器中进行,随着反应的进行,容器内温度升高,平衡状态会逆向移动,平常常数减小;故答案为:$\frac{1}{c(C{O}_{2}){c}^{2}(N{H}_{3})}$;减小;
(5)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g)?NH2CO2NH4(s)
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.15 0.075
平衡量(mol/L) 0.05 0.025
t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图2所示.若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol/L,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为: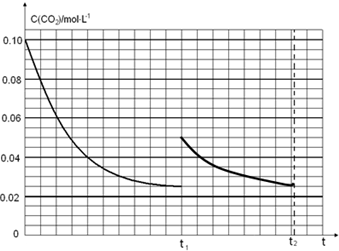 ,故答案为:
,故答案为: ;
;
(6)尿素在土壤中会发生反应CO(NH2)2+2H2O?(NH4)2CO3.分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质:
A.NH2COONH4 ,结构中含有与羰基连接的氨基,故A符合;
B.H2NOCCH2CH2CONH2 结构中含有与羰基连接的氨基,故B符合;
C.HOCH2CH2OH,结构中不含有氨基,故C不符合;
D.HOCH2CH2NH2,分子中的氨基不是和羰基连接,不具备次性质,故D不符合;
故答案为:A、B.
点评 本题考查了热化学方程式书写,反应自发进行的判断依据,化学平衡的标志判断,掌握基础是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol白磷(P4,结构如图)含有2NA个P-P键 | |
| B. | 23g钠与在一定条件下与氧气作用,若两者均无剩余,转移NA个电子 | |
| C. | 1mol/L(NH4)2SO4溶液中,含SO2-4NA个,NH+4少于2NA个 | |
| D. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
| Ⅰ.2H2(g)+CO(g)?CH3OH(g)△H1=akJ•mol-1 | 2.5 | 0.2 |
| Ⅱ.H2(g)+CO2(g)?H2O(g)+CO(g)△H2=bkJ•mol-1 | 1.0 | 2.3 |
| Ⅲ.3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H3=ckJ•mol-1 | K3 | 4.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 共价键 | C-O | H-O | N-H | C-N |
| 键能/kJ•mol-1 | 351 | 463 | 393 | 293 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
(1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚氯乙烯的结构简式为: | B. | 乙醇的官能团的电子式为: | ||
| C. | S2-的结构示意图为: | D. | 乙酸的实验式为C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和C12都能用于漂白 | B. | 苯酚、乙烯都能跟溴水反应 | ||
| C. | 苏打、小苏打水溶液的pH都大于7 | D. | I2,NH4Cl晶体受热都逐渐消失 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com