
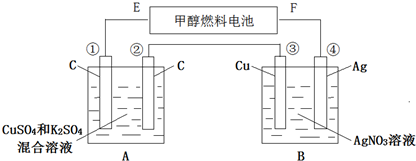
���� ��A��Bװ��ͨ��һ��ʱ�������3.2g�״��μӷ�Ӧ�Ң۵缫���أ���˵���۵缫�������ӵõ���������������ǵ������������Ԣܢ�������������������ԭ�����E�Ǹ�����F��������ԭ��ظ����ϼ״�ʧ���ӷ���������Ӧ������������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ��
��1��E�Ǹ�����F�������������ϼ״�ʧ��������̼������ӣ�
��2�������У����������ӵõ������������ʣ�Bװ���������������ӵõ��ӣ�������Agʧ�������������ӣ���Һ��������Ũ�Ȳ��䣻
��3���������������ϵ�ʧ�����غ���㣻
��4��A�е�����ɵ����ʣ�������������������������������Cu��������Һʧȥ��Ԫ�ط�����
��� �⣺��1����A��Bװ��ͨ��һ��ʱ�������1.6g�״��μӷ�Ӧ�Ң۵缫���أ���˵���۵缫�������ӵõ���������������ǵ������������Ԣܢ�������������������ԭ�����E�Ǹ�����F�������������ϼ״�ʧ��������̼������ӣ����缫����ʽΪ��CH3OH+8OH--6e-�TCO32-+6H2O��
�ʴ�Ϊ��������CH3OH+8OH--6e-�TCO32-+6H2O��
��2�������У����������ӵõ������������ʣ��ܵ缫����ʧ�������������ӽ�����Һ���缫��ӦʽΪ��Ag-e-=Ag+��Bװ���������������ӵõ��ӣ�������Agʧ�������������ӣ���Һ��������Ũ�Ȳ��䣬������Һ��pH���䣻
�ʴ�Ϊ��Ag-e-=Ag+�����䣻
��3����3.2g�״���Ӧת�Ƶ��ӵ����ʵ�����x��
CH3OH+8OH--6e-�TCO32-+6H2O ת�Ƶ���
32g 6mol
3.2g x
x=$\frac{3.2g��6mol}{32g}$=0.6mol
��A����ԭ���Һ�����Ϊ500mL��CuSO4��K2SO4Ũ�Ⱦ�Ϊ0.3mol/L����ͭ���ӵ����ʵ���Ϊ0.3mol/L��0.5L=0.15mol����ͭ������ȫ����ʱ��ͭ���ӵõ����ӵ����ʵ���=0.15mol��2=0.3mol��0.6mol�����Ե������Һʱ��������������ͭ��������������������������������ʧ���ӵ����ʵ�������0.6mol��
���������������������ʵ�����y���������������������ʵ�����z��
��0.15mol��2+2y=4z=0.6mol��y=0.15mol��z=0.15mol������A���й��ռ�������������ʵ����ǣ�0.15+0.15��mol=0.3mol�����������=0.3mol��22.4L/mol=6.72L������ͭ���ӵõ�����������ͭ��ͭ���ӵ����ʵ���Ϊ0.3mol/L��0.5L=0.15mol�����������ӵõ������������ʣ����ݵ����غ㣬ת��0.6mol����������������0.6mol�������缫�����������ʵ���֮��Ϊ1��4��
�ʴ�Ϊ��6.72�� 1��4��
��4��A�е�����ɵ����ʣ�������������������������������Cu��������ʹͨ������Һ�ָ���ԭ״���ɼ���һ��������������ͭ��
�ʴ�Ϊ��������ͭ��
���� ���⿼����ԭ��غ͵���ԭ����ע�⣨4�����У������ϲ�������ͭ���������������������ϵõ�����������ԭ�����ת�Ƶ��������м��㣬�Ӷ��ó���������������Ϊ�״��㣬�����ڿ���ѧ���ķ��������ͼ�����������Ŀ�Ѷ��еȣ�


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ԭ�����Һ��ֻ����Na+��Fe3+��SO42-�������ܴ���K+��CO32- | |
| B�� | ��ʵ�飨1�����ƶ�ԭ�����Һ���Ƿ���SO42- | |
| C�� | ��ʵ�飨2�����ƶ�ԭ�����Һ���Ƿ���Fe3+ | |
| D�� | ��ʵ�飨3�����ƶ�ԭ�����Һ�д���Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl | B�� | NaOH | C�� | Na2SO4 | D�� | NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���붬��������ʼ��ů�����������������أ�����PM2.5��PM10������������������������������Ⱦ���У���Ϊ�������ǻ�����β���еĵ��������ȼú������������
���붬��������ʼ��ů�����������������أ�����PM2.5��PM10������������������������������Ⱦ���У���Ϊ�������ǻ�����β���еĵ��������ȼú������������ʱ��/min �¶�/�� | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | �� | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2 | B�� | CaO | C�� | Na2O2 | D�� | Al2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ�κ�ʳ�� | B�� | ʳ�κʹ��� | C�� | �����ʳ�� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com