
| A. | 氨基酸、淀粉均属于高分子化合物 | |
| B. | 乙醇不能发生取代反应 | |
| C. | 苯能使溴水褪色是因为发生了加成反应 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
分析 A.根据高分子化合物的定义判断;
B.乙醇含有羟基,可发生取代反应;
C.苯与溴水不反应;
D.乙烯含有碳碳双键,可发生加成反应.
解答 解:A.高分子化合物的相对分子质量在10000以上,多为高聚物,而氨基酸不是高分子化合物,故A错误;
B.乙醇含有羟基,可发生取代反应,与乙酸的酯化反应,故B错误;
C.苯与溴水不反应,可在催化作用下与液溴发生取代反应,故C错误;
D.乙烯含有碳碳双键,可发生加成反应,可用溴的四氯化碳溶液鉴别,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系解答的关键,侧重分析与应用能力的考查,注意高分子化合物的定义,题目难度不大.


科目:高中化学 来源: 题型:解答题
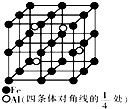 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为:2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4Cl2有三种同分异构体 | |
| B. | 将苯与浓硝酸和浓硫酸共热制取硝基苯 | |
| C. | 将红热的铜丝迅速插入无水乙醇中可将乙醇氧化为乙醛 | |
| D. | 可用浓硝酸鉴别淀粉溶液和鸡蛋白溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质跟浓盐酸作用时呈黄色 | |
| B. | 聚乙烯塑料制品可用于食品的包装,而聚氯乙烯不能用于食品包装 | |
| C. | 木糖醇(C5H12O5)是一种甜味剂,与葡萄糖互为同系物 | |
| D. | 将一小块钠加入乙醇中,钠浮于乙醇上,缓慢反应生成氢气,说明乙醇中羟基上的氢原子相对于水不活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<z | B. | 平衡逆向移动 | C. | A的转化率降低 | D. | C的体积分数升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
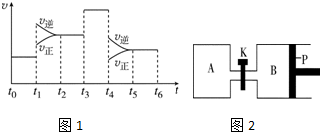
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甘油可作护肤保湿剂 | |
| B. | 无水氯化钙可用作食品干燥剂 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
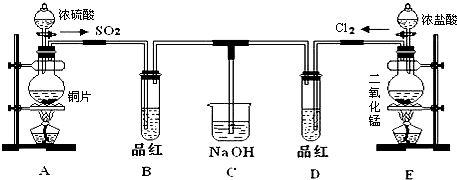
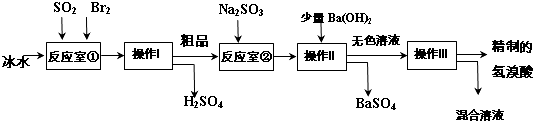
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com