
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 25℃,1.01105Pa,64gSO2中含有的原子数不是标准状况不能计算
B. 通常状况下,NA 个CO2分子占有的体积为22.4 L
C. 46g二氧化氮(NO2)和46g四氧化二氮(N2O4)含有的原子数不一样多
D. 常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】实验小组按如下流程,进行海带中碘含量的测定和碘的制取等实验。
I. 碘含量的测定

(1)步骤①是将海带置于__________中(填仪器名称)进行灼烧。
(2)步骤④是将溶液转移至________________(填定容仪器的名称)。
(3)取20.00mL 上述海带浸取原液,加稀H2SO4和足量KIO3,使![]() 和
和![]() 完全反应(
完全反应(![]() )。再以淀粉为指示剂,用
)。再以淀粉为指示剂,用![]() mol/L的Na2S2O3溶液滴定(
mol/L的Na2S2O3溶液滴定(![]() ),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
(4)判断用Na2S2O3溶液滴定恰好完全反应的现象是__________________________。
(5)计算该干海带中碘的质量分数_________________。
II. 碘的制取
另制海带浸取原液,按如下方案制取碘:
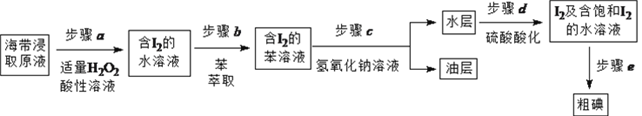
(1)补全步骤![]() 的反应方程式,配平并标出电子转移的数目和方向。
的反应方程式,配平并标出电子转移的数目和方向。
![]() ,_______________
,_______________
(2)步骤![]() 加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
(3)步骤![]() 的操作是_______________。
的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,可充电的钠——二氧化碳电池是当今新能源领域的热点,具有优异的性能。下列说法正确的是( )
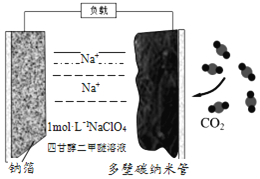
A. 钠金属片为正极
B. 该电池中的电解质为NaClO4,工作时ClO4-向碳纳米管电极移动
C. 总反应为:![]()
D. 放电时,每消耗3molCO2,转移12mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2O的摩尔质量为:_________ , 36 g 水的物质的量为:_____________如果将这36 水完全电解生成H2和 O2,则所得H2在标况下的体积约为:_________________
(2)1 mol Na2O2中所含阴离子数的个数约为:_________(用NA表示)
(3)将0.5 mol Na2CO3固体加水溶解配成250 mL溶液, c(Na+)=____ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.正丁烷和异丁烷属于同系物
B.乙烯和苯都能与 H2 发生加成反应,说明二者的分子中均含碳碳双键
C.乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应要缓慢
D.乙醛能被还原成乙醇,但不能被氧化成乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关染发剂的说法错误的是( )
A.选择毒性、刺激性较小的染发剂,如植物性染发剂,减少染发剂对人体的伤害
B.染发时应严格遵守染发剂使用说明,不要混合使用不同的染发剂
C.尽量少染发,当头皮有伤口时不要染发
D.染完头发后,不必清洗多次次,以免影响染发效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上接触法生产硫酸的主要反应为:SO2(g)+ ![]() O2(g)
O2(g)![]() SO3(g)。
SO3(g)。
(1)恒溫恒压下,平衡体系中SO3体积分数与SO2、O2物质的量之比的关系如图1,则b 点n(SO2)/n(O2)=_____________________。

(2)①该反应的催化剂为V2O5,其催化反应过程为:SO2+V2O5![]() SO3+V2O4 K1
SO3+V2O4 K1 ![]() O2+V2O4
O2+V2O4 ![]() V2O5 K2。则在相同温度下2SO2(g)+O2(g)
V2O5 K2。则在相同温度下2SO2(g)+O2(g) ![]() 2SO3(g)的平衡常数K=_________(以含K1、K2的代数式表示)。
2SO3(g)的平衡常数K=_________(以含K1、K2的代数式表示)。
②V2O5加快反应速率的原因______________________。
(3)某实验从废钒催化剂(主要成分为V2O5和V2O4) 中回收V2O5,其简要过程如下:

(VO2+和VO2+可看成是钒相应价态的简单阳离子完全水解的产物)
①写出水解生成VO2+的离子方程式____________________________。
②在沉钒时,为使钒元素的沉淀率达到98%,至少应调节溶液中的c(NH4+)为_________(25℃,Ksp (NH4VO3) =1.6×10-3,溶液体积变化忽略不计)
(4)在保持体系总压为0.1MPa的条件下进行反应:SO2(g)+ ![]() O2(g)
O2(g)![]() SO3(g),原料气中SO2 和O2的浓度之比(k)不同时,SO2的平衡转化率与温度(t) 的关系如图2所示:
SO3(g),原料气中SO2 和O2的浓度之比(k)不同时,SO2的平衡转化率与温度(t) 的关系如图2所示:

①图中k1、k2、k3的由大到小的顺序为____________,理由是___________________。
②图2 中A 点原料气成分为n(SO2)∶ n(O2)∶n(N2)=7∶11∶82。若反应开始时容器体积为V1,A点时容器体积为V2,则V1∶V2=_________(保留三个有效数字)
③近年,有人研发出用氧气代替空气的新工艺,使SO2趋于完全转化。此工艺的优点除了能充分利用含硫的原料外,主要还有____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com