
【题目】现有部分短周期元素的原子结构如下表:
元素编号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素符号:____________,元素Y的最简单氢化物的化学式为______________。
(2)Z元素原子的相对原子质量为____________。
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为______________。
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式为__________________。
【答案】N CH4 23 H++OH-=H2O 2CO2+2Na2O2=2Na2CO3+O2
【解析】
由 X原子结构示意图为![]() 可知,a=7,质子数为7的元素为氮;由Y元素最外层电子数是次外层电子数的2倍,所以Y元素为碳元素;由Z的原子核内含有12个中子,且其离子的结构示意图为
可知,a=7,质子数为7的元素为氮;由Y元素最外层电子数是次外层电子数的2倍,所以Y元素为碳元素;由Z的原子核内含有12个中子,且其离子的结构示意图为![]() ,可知Z为Na元素;以此分析解答。
,可知Z为Na元素;以此分析解答。
(1)由 X原子结构示意图为![]() 可知,a=7,质子数为7的元素为氮,元素符号为N;由Y元素最外层电子数是次外层电子数的2倍,所以Y元素为碳元素,其最简单氢化物为甲烷,化学式为CH4。答案:N; CH4;
可知,a=7,质子数为7的元素为氮,元素符号为N;由Y元素最外层电子数是次外层电子数的2倍,所以Y元素为碳元素,其最简单氢化物为甲烷,化学式为CH4。答案:N; CH4;
(2)由Z的原子核内含有12个中子,且其离子的结构示意图为![]() ,可知Z为Na元素,其原子的相对原子质量为23;答案:23;
,可知Z为Na元素,其原子的相对原子质量为23;答案:23;
(3)X为N元素,最高价氧化物对应的水化物为HNO3;Z为Na元素,最高价氧化物对应的水化物为NaOH,两者相互反应的离子方程式为H++OH-=H2O。答案:H++OH-=H2O;
(4) 由Y元素为碳,最高价氧化物为CO2;Z元素为Na,最高价氧化物为Na2O和Na2O2,两者发生氧化还原反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2,答案:2CO2+2Na2O2=2Na2CO3+O2。


科目:高中化学 来源: 题型:
【题目】水合肼(N2H4H2O)是无色、有强还原性的液体,能与水、醇任意混合,不溶于乙醚和氯仿。实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4H2O+NaCl,据此,某学生设计了下列实验。
已知:①NaClO受热易分解为NaCl和NaClO3
②N2H4H2O的沸点约118℃
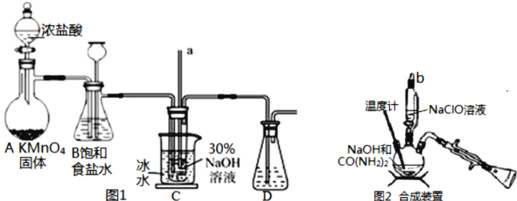
Ⅰ.制备NaClO溶液(如图1)
(1)用烧碱固体配制30%NaOH溶液时,所需玻璃仪器除玻璃棒外还有___(填字母)。
A.容量瓶 B.移液管 C.烧杯 D.量筒
(2)B中的长颈漏斗和C中的玻璃管a在实验中的作用相同,均为___。C中用冰水浴控制温度在25℃以下,其主要目的是___。
Ⅱ.制取水合肼(如图2)
(3)实验中要滴入NaClO溶液___(选填“需要”或“不需要”)打开玻璃塞b。
(4)反应过程中,若将CO(NH2)2滴加到NaClO中,将会产生大量氮气,降低水合肼的产率,原因是___(用化学方程式表示)。充分反应后,把“合成装置”内的溶液经过___(填操作)处理,即可得到水合肼的粗产品。
Ⅲ.定量测定
(5)称取馏分0.20g,加水配成20.00mL溶液,在一定条件下,用0.30molL-1I2的标准液进行滴定。
①滴定时,用___(填仪器名称)装标准液。
②水合肼与I2反应的化学方程式为___。
③实验测得消耗I2溶液的平均值为20.00mL,则馏分中N2H4H2O的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的两种弱酸HA和HB分别加水稀释,pH随溶液体积变化的曲线如图所示。下列判断正确的是( )
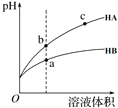
A.酸性:HB> HA
B.结合H+的能力:B->A-
C.导电能力:c > b
D.与氢氧化钠完全反应时,消耗氢氧化钠体积Va<Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验主要仪器和试剂的选择不能达到实验目的的是
选项 | 主要仪器 | 试剂 | 实验目的 |
A | 烧瓶、长颈漏斗、酒精灯、导管 | 软锰矿与浓盐酸 | 制取并收集干燥的氯气 |
B | 酒精灯、玻璃棒、蒸发皿、三脚架 |
| 蒸发溶液得到晶体 |
C | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的氨气、水 | 模拟喷泉实验 |
D | 铁丝、蓝色钴玻璃、酒精灯 | 盐酸、待测液 | 焰色反应实验 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程如下:

⑴Na2Cr2O7可由FeO·Cr2O3先氧化、再酸化得到。其中FeO·Cr2O3发生氧化反应的化学方程式为4FeO·Cr2O3+7O2+20NaOH![]() 8Na2CrO4+4NaFeO2+10H2O。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为______mol。
8Na2CrO4+4NaFeO2+10H2O。该反应中每生成1 mol NaFeO2,被Fe元素还原的O2的物质的量为______mol。
⑵“调节pH=4”后,溶液中c(Fe3+)=4×10-8 mol·L-1,则该温度下Ksp[Fe(OH)3]=______。
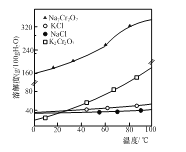
⑶已知部分物质的溶解度曲线如图所示。反应Ⅰ的化学反应类型为______。实验室由质量分数为10%的K2Cr2O7溶液获取K2Cr2O7晶体的方法是______。
⑷为测定K2Cr2O7样品纯度(杂质不参与反应),实验过程为:准确称量一定质量样品,与足量酸性KI 溶液充分反应后,用Na2S2O3标准溶液滴定生成的I2。实验过程中发生的物质转化关系分别为:Cr2O72-![]() Cr3+ S2O32-
Cr3+ S2O32-![]() S4O62-,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
S4O62-,根据电子得失守恒可知n(K2Cr2O7)∶n(Na2S2O3)=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种重要的化工原料,下列有关说法正确的是( )。
A.苯可以在空气中燃烧,燃烧时产生明亮并带有浓烟的火焰
B.苯分子中含有碳碳双键,所以可使酸性高锰酸钾溶液褪色
C.苯中加入溴水,振荡后溶液分层,水层无色,说明苯与溴水发生了取代反应
D.苯与氢气催化条件下可发生加成反应,产物环己烷的二氯代物有3种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片5.0 g投入盛有 500 mL 0.5 mol·L-1的硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,回答下列问题:
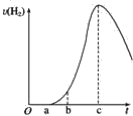
(1)曲线由O→a段不产生氢气的原因是__________________;
(2)曲线由a→c段,产生氢气的速率增加较快的主要原因是______________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 ℃时,将0.100 mol的N2O4气体充入1 L 抽空的密闭容器中,发生如下反应:N2O4![]() 2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
2NO2,隔一定时间对该容器内的物质进行分析,得到下表:
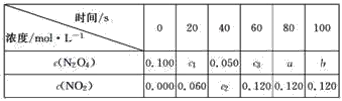
(1)达到平衡时,N2O4的转化率为______________,表中c2________c3,a________b(填“>”、“<”或“=”)。
(2)20 s时N2O4的浓度c1=________ mol·L-1,在0~20 s内N2O4的平均反应速率为________ mol·L-1·s-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,则要达到上述同样的平衡状态,二氧化氮的起始浓度是________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列说法正确的是( )
A. 通常状况下,氢气的燃烧热为241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和1/2 mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用右图表示2CO2(g)===2CO(g)+O2(g)反应过程中的能量变化关系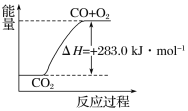
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com