
【题目】氧化铜矿石含有CuO和难溶于水的Cu2(OH) 2CO3 , 还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某厂生产硫酸铜和硫酸亚铁流程如下: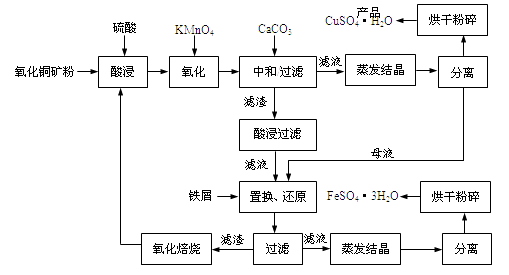
(1)氧化铜矿石粉碎的目的是,KMnO4的作用是将Fe2+氧化成Fe3+。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是,使Fe3+ 水解成沉淀而除去。
(4)流程中多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、。
(5)加入铁屑的作用是使母液中Fe3+转化为Fe2+、。
(6)下表为硫酸铜晶体“烘干粉碎”的试验结果。
表中m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水个数。据此可确定由CuSO4·5H2O脱水得流程所示产品的适宜工艺条件为(指出条件的温度和时间)。
【答案】
(1)增大接触面积 (或加快化学反应速率);使Fe2+转化为Fe3+
(2)Cu2(OH) 2CO3+H2SO4=2CuSO4+3H2O+CO2↑
(3)适当降低溶液的酸性,使Fe3+水解成沉淀而除出
(4)玻璃棒、漏斗
(5)使母液中Fe3+转化为Fe2+,除去Cu2+,提高硫酸亚铁晶体的纯度
(6)160℃、3h。
【解析】
解:(1)根据影响化学反应速率的因素,粉碎矿石的目的是增大反应接触面积,加快反应速率;根据杂质的成分,加入高锰酸钾溶液的作用是把Fe2+氧化成Fe3+,便于除去杂质;
(2)碱式碳酸铜可以看作是Cu(OH)2·CuCO3,因此反应的方程式为:Cu2(OH) 2CO3+H2SO4=2CuSO4+3H2O+CO2↑;
(3)加入CaCO3的目的是调节pH,使Fe3+全部转化成Fe(OH)3,而除去;
(4)过滤所使用的玻璃仪器是玻璃棒、漏斗、烧杯;
(5)根据流程图,滤液中含有Fe3+和少量的Cu2+,实验目的是制备FeSO4·3H2O,因此加入铁屑的作用是:使母液中Fe3+转化为Fe2+,除去Cu2+,提高硫酸亚铁晶体的纯度;
(6)根据实验目的制备CuSO4·H2O,对应的数值为3h和160℃。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用浓海水提镁的一段工艺流程如下图:
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是 . 在上述流程中,可以循环使用的物质是 .
(2)在该工艺过程中,X试剂的化学式为 .
(3)“一段脱水”目的是制备MgCl22H2O;“二段脱水”的目的是制备电解原料.若将MgCl26H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为 .
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为g.
(5)以LiCl﹣KCl共熔盐为电解质的Mg﹣V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 该电池的正极反应式为 .
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则: Mg(s)+2B(s) MgB2(s)△H= . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素的原子的L层比B元素的L层少3个电子,B元素原子核外电子比A元素总电子数多5个,则A、B可形成
A. 共价化合物B2A3B. 离子化合物B2A3
C. 共价化合物B3A2D. 离子化合物B3A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2 , 实验装置如图所示:回答下列问题: 
(1)仪器a的名称为;装置C的作用是 .
(2)该实验必须使NaClO3稍微过量,目的是 .
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 .
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 则另一种为 .
(5)B中反应的离子方程式为 .
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入(填序号,下同)酸化,再加入检验. ①稀HNO3②稀H2SO4③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO23H2O(相对质量:144.5),至少需g NaClO3(相对质量:106.5).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。 第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。 第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是( )
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,在4.0L恒容密闭容器中充入2.0mol PCl5 , 发生反应:PCl5(g)PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(1)由总压强p和起始压强p0计算反应物PCl5的转化率α(PCl5)的表达式为?平衡时PCl5的转化率为多少?
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷分子结构的叙述中,正确的是
A. 甲烷分子中C、H原子间是离子键B. 甲烷分子的空间结构是正方体
C. 甲烷的结构式为CH4D. 甲烷分子中4个碳氢键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( ) 
A.①压强对反应的影响(p2>p1)
B.②温度对反应的影响
C.③平衡体系增加N2对反应的影响
D.④催化剂对反应的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com