
| A. | 常温下pH=7的溶液中:Fe3 +、Mg2 +、SO4 2-、Cl- 能大量共存 | |
| B. | 25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大 | |
| C. | 浓度均为0.1 mol•L- 1 的下列溶液,pH由大到小的排列顺序为:NaOH>Na2 CO3>(NH4 )2 SO4>NaHSO4 | |
| D. | 常温下水电离出c(H+ )×c(OH- )=10-20 的溶液中:Na+、ClO-、SO42 -、NH4 + 可能大量共存 |
分析 A.铁离子只能存在于酸性溶液中;
B.氯离子浓度增大,氯化银的溶解度会减小;
C.酸性、中性和碱性溶液的pH大小为:碱性>中性>酸性,结合盐的水解程度较小判断;
D.该溶液呈酸性或碱性,次氯酸根离子与氢离子反应,铵根离子与氢氧根离子反应.
解答 解:A.Fe3+只能存在于酸性溶液,在pH=7的溶液中不可能大量存在,故A错误;
B.向AgCl沉淀的溶解平衡体系中加入NaCl固体,溶液中氯离子浓度增大,抑制了氯化银的溶解平衡,则AgCl的溶解度减小,故B错误;
C.NaOH为强碱,碳酸钠为强碱弱酸盐,二者呈碱性,pH>7,硫酸铵为强酸弱碱盐,硫酸氢钠呈强酸性,二者的pH<7,盐的水解程度减小,则浓度相同时pH由大到小的排列顺序为:NaOH>Na2 CO3>(NH4)2SO4>NaHSO4,故C正确;
D.常温下水电离出c(H+ )×c(OH- )=10-20>10-14,说明促进了水的电离,溶液呈酸性或碱性,ClO-与氢离子反应,NH4+与氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选C.
点评 本题考查较为综合,涉及难溶物溶解平衡、溶液酸碱性与溶液pH的关系、离子共存等知识,题目难度中等,明确离子共存的条件为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯生成乙烷、乙醇生成乙醛均属于加成反应 | |
| B. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| C. | 蚕丝和人造纤维均为高分子化合物,用灼烧的方法可区别 | |
| D. | 葡萄糖和果糖的分子式均为C6H12O6,二者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
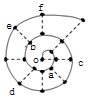 同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 最高价氧化物对应的水化物的碱性:c<a | |
| B. | 简单离子半径:c>e>b | |
| C. | 简单离子影响水的电离能力:e>a>f | |
| D. | 单质的熔点:c>d>e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-34 | 10-16 | 10-38 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2H2O(g)=2H2(g)+O2(g)△H=+483.6KJ/mol | |
| B. | H2的燃烧热为241.8 KJ/mol | |
| C. | 浓硫酸与氢氧化钠溶液反应生成1molH2O(I),放出热量也等于57.3KJ | |
| D. | 稀CH3COOH溶液与稀NaOH溶液反应生成1molH2O(l),放出热量小于57.3KJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com