
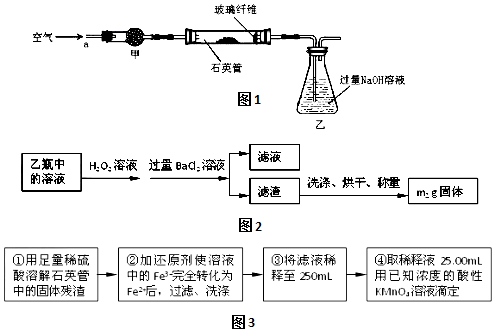
分析 (1)石英管中发生反应是高温下FeS2被氧气氧化成二氧化硫和三氧化二铁;
(2)甲中使用固体干燥剂,用于除掉空气中的水分,所以选用碱石灰;装置乙易发生倒吸现象;
(3)根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数;
(4)铁和铁离子反应生成的亚铁离子物质的量增大;若将稀释液久置,溶液中的亚铁离子部分被氧化成铁离子;
(5)根据一定物质的量浓度溶液的配制中需使用的仪器完成;
(6)酸性高锰酸钾溶液氧化亚铁离子生成铁离子.
解答 解:(1)高温下,FeS2被氧气氧化成二氧化硫和氧化铁,根据化合价升降相等配平:二硫化亚铁当做整体,化合价总共升高了(1×1+5×2)=11价,氧气化合价降低4价,所以氧气前面配11,二硫化亚铁前面配4,配平后的化学方程式为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2;
(2)由于甲装置需要使用固体干燥剂,用于除掉空气中的水分,可以选用碱石灰(或氢氧化钠固体或氧化钙固体),该实验装置存在安全隐患是乙装置中液体易到吸入玻璃管,
故答案为:碱石灰(或氢氧化钠固体或氧化钙固体);装置乙易发生倒吸;
(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,
S-----BaSO4
32g 233g
x m2g
x=$\frac{32{m}_{2}}{233}$g
质量分数=$\frac{32{m}_{2}}{233{m}_{1}}$×100%,
故答案为:$\frac{32{m}_{2}}{233{m}_{1}}$×100%;
(4)铁和铁离子反应生成的亚铁离子物质的量增大,用高锰酸钾物质的量增大,测定结果偏高,故答案为:偏高;
(5)一定物质的量浓度溶液的配制中,除了烧杯、玻璃棒、胶头滴管外,还需要250mL容量瓶,故答案为:250mL容量瓶;
(6)④中发生反应为高锰酸钾溶液氧化亚铁离子生成铁离子,氧化还原反应离子方程式为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O,
故答案为:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O.
点评 本题考查物质成分和含量的测定,涉及仪器选用、误差分析、质量分数计算等知识,具有较强的综合性,解题时注意从质量守恒的角度分析,题目难度中等.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题
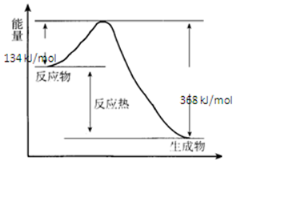 (1)下列反应中,属于吸热反应的是④⑤⑦.
(1)下列反应中,属于吸热反应的是④⑤⑦.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
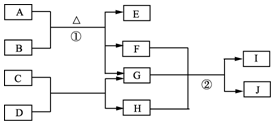 有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题:
有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g)不能自发进行,则该反应的△H<0 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 电解冶炼铝时需定期更换阳极的石墨电极 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁片与足量浓H2SO4在加热的条件下可生成1.5NA个SO2分子 | |
| B. | 标准状况下20g D2O分子中所含中子数为10NA | |
| C. | 常温下,将0.1NA个氯化氢分子溶于1L水中,得到0.1mol/L的盐酸 | |
| D. | 2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
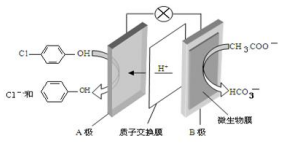 现在污水治理越来越引起人们重视,可以通过
现在污水治理越来越引起人们重视,可以通过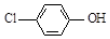 膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是.
膜电池除去废水中的乙酸钠和对氯苯酚( ),其原理如图所示,下列说法正确的是.| A. | 电流方向从B极沿导线经小灯泡流向A极 | |
| B. | A极的电极反应式为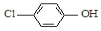 +e-═Cl-+ +e-═Cl-+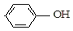 | |
| C. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+的个数为0.1NA | |
| D. | B极为电池的正极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe不能与水蒸气发生化学反应 | |
| B. | 白色Fe(OH)2在空气中放置最终变成灰绿色 | |
| C. | 铝可以与氢氧化钠溶液发生反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ | |
| D. | 氯化铁溶液不能与铜单质发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
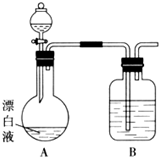 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com