


科目:高中化学 来源:不详 题型:单选题
| A.该反应中的氧化剂是Cl2 |
| B.SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
| C.上述反应中,每生成1 mol SO42—,可脱去2 mol Cl2 |
| D.根据该反应可判断还原性:S2O32—>Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mol
mol mol
mol L
L +
+ )mol
)mol| A.5项 | B.4项 | C.3项 | D.2项 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe与Al 的物质的量之比为1:1 |
| B.混合气体中NO为0.03mol ,N2O为0.12mol |
| C.原HNO3溶液的浓度C=4.9mol/L |
| D.反应中被还原的HNO3为0.15mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5 mol/L | B.7 mol/L | C.10 mol/L | D.12 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.一定条件反应:2CO(g)  CO2(g)+C(s)可自发进行,则该反应的△H>0 CO2(g)+C(s)可自发进行,则该反应的△H>0 |
| B.向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明溶液已变质 |
| C.在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,当生成1.5mol Cl2时,反应中转移的电子数为2.5NA |
| D.相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3·H2O,水电离程度由大到小的顺序是:①>②>③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。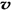 (N2)/
(N2)/ 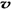 (O2)=2:3
(O2)=2:3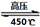 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+4 | B.+7 | C.+6 | D.+5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com