
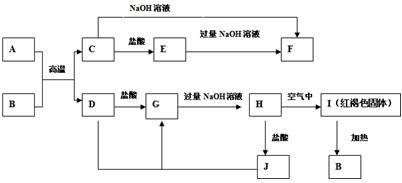


科目:高中化学 来源: 题型:
| A、500mL1mol/L 的 NaCl 溶液 |
| B、500mL1mol/L 的 MgCl2溶液 |
| C、100mL3mol/L 的 NaCl 溶液 |
| D、600mL1mol/L 的 NaCl 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
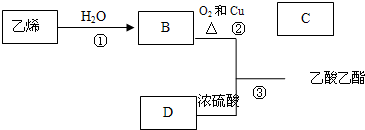
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该分子中所有碳原子可以稳定的共存在一个平面中 |
| B、遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| C、1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| D、滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com